Dissertação no âmbito do Mestrado em Alimentação: Fontes, Cultura e Sociedade orientada pela Professora Doutora Paula Barata Dias e apresentada à Faculdade de Letras da Universidade de Coimbra.
Setembro de 2019
RESUMO
A aquicultura é um sector em crescimento, com ela vemos desenvolver-se também o interesse pelos cultivos multitróficos que assegurem a alimentação das ostras (assim como peixes e outras espécies secundárias) sob a forma de matéria em suspensão. Presentemente, o consumo de alimentos não é apenas um meio para satisfação das necessidades básicas, estando a assumir-se cada vez mais como uma função social e cultural influenciada por tudo o que nos rodeia.
Setúbal foi sempre uma região vocacionada para a actividade piscatória. A alimentação é a principal razão para as práticas da pesca. No contexto da presente investigação, destaca-se a relação das pescas com a alimentação desta região específica e a importância do sector que assegura centenas de empregos, em diversas áreas, como o do comércio de peixe fresco, das conservas, dos congelados, das farinhas, da construção/reparação naval, da cordoaria, dos transportes, da administração, da investigação, da formação, entre outros [1]
1 Reis, C. Alimentação e pescas: A utilização do meio marinho e dos seus recursos vivos. In: O futuro da alimentação: ambiente, saúde e economia, Lisboa: Fundação Calouste Gulbenkian, 2013
A ostra-portuguesa, Crassostrea angulata, tem uma grande importância gastronómica, económica e ecológica a nível mundial. No estuário do Sado foi particularmente relevante na produção aquícola até à década de 1970, quando mortalidades em massa quase levaram à sua extinção no local. Actualmente, tal situação parece ter-se alterado, mas é necessário desenvolver trabalhos científicos que o demonstrem.
Esta dissertação tem como objectivo estudar as ostras de Setúbal e apresentar uma revisão bibliográfica sobre a sua influência nas actividades económicas e gastronómicas na região. A primeira parte foca-se na produção de ostras, características microbiológicas, distribuição geográfica, conservação e consumo. Na segunda parte, fazemos uma abordagem histórica sobre a cidade, desde os concheiros do Sado, passando pela ocupação romana e reconquista cristã, até aos tempos modernos. Na terceira parte, apresentamos a ostra como identidade alimentar da região de Setúbal, com todas as actividades em volta deste produto.
ABSTRACT
The aquaculture sector is growing rapidly. Simultaneously, the interest in multi-trophic cultures has also increased, which combine fed aquaculture species like finfish with secondary species that feed of suspended matter like oysters. Nowadays, the consumer has at his disposal a variety of food products that make food selection a much more complex task compared to the past. Cultural, social, personal and psychological differences influence the behavior and perception of the consumer.
Setúbal was always a region with a strong background fishing activity. Food is the main reason for fishing practices. The present investigation aims to highlight the relationship between fisheries and food in this specific region and the importance of the sector, which provides hundreds of jobs in a number of areas, such as trade in fresh fish, preserved foods, frozen foods, flours, shipbuilding / repair, transport, administration, research, training, among others.
The Portuguese oyster, Crassostrea angulata, has a very high gastronomic, economic and ecological importance worldwide. In the Sado estuary, it was particularly relevant in aquaculture production until the 1970s, when mass mortalities almost led to its extinction in this area. Nowadays, this situation seems to have changed, but it is necessary to develop new and better scientific tools confirm it.
The main goal of this work is to study the oyster in Setúbal and to review the literature on its influence on economical and gastronomical activities. The first part focuses on the production of oysters, microbiological characteristics, geographical distribution, conservation and consumption. In the second part, there is a historical approach to the city, from Concheiros do Sado, through Roman occupation and Christian reconquest, to modern times. The third part explores the oyster as food identity of the region of Setúbal and the activities around this product.
A variedade de criaturas marinhas é quase infinita, assim como as transformações químicas e físicas que ocorrem com elas na cozinha. Apesar do nome “frutos do mar” (designação do português do Brasil) ou “marisco” (designação do português europeu), estes são na verdade animais invertebrados comestíveis, que geralmente possuem uma concha ou carapaça, como os crustáceos ou moluscos. São extraídos do mar ou água doce e são uma fonte importante de proteína, vitaminas e minerais. No inglês, seafood, traduz-se literalmente por “comida do mar” (ou também tem o nome shellfish, peixe com carapaça). No francês, fruits de mer é igual à designação do português do Brasil, de que é provavelmente a origem). [2].
Os crustáceos caracterizam-se por possuírem carapaça (e/ou esqueleto externo), onde se prendem os músculos.

(Figura 1 (A) Larva da lagosta-europeia;

(B) Cowry, caracol-aquático.)
Em geral, têm um par de mandíbulas, dois pares de antenas e dois pares de maxilas. Os corpos moles dos crustáceos são cobertos por placas de quitina articuladas como armaduras, de forma não a proporcionar mobilidade, mas proteger contra predadores. Alguns exemplos são o camarão, percebes, lagostas, lagostim e caranguejo [3].
Os moluscos são animais que possuem uma concha, às vezes duas, que protegem os seus corpos, com excepção apenas do polvo e da lula, que têm tentáculos.
Dividem-se em univalves, bivalves e cefalópodes. Univalves são os que possuem apenas uma concha, como por exemplo, o ouriço-do-mar; bivalves são os que têm duas conchas, ligadas por uma articulação, como, por exemplo, o mexilhão, a ostra e a vieira; já os cefalópodes são os que possuem tentáculos ou braços ligados directamente à cabeça (como a lula e o polvo) [4].
A maioria destes seres vivos tem como base da sua alimentação fitoplâncton e zooplâncton [2], [5]. (2004)
2 Hickman, C. Integrated Principles Of Zoology, 11th Edition ed., McGraw-Hill Education, 2002.
3 Martin,G. “An Updated Classification of the Recent Crustacea”, em Natural History Museum of Los Angeles County. Science Series nº 39, p. 124pp.
4 Rosenberg, G. “A new critical estimate of named species-level diversity of the recent Mollusca”, American Malacological Bulletin, vol. 32(2), pp. 308-322
5 Ruppert, E. Invertebrate Zoology: A Functional Evolutionary, Belmont: Brooks Cole., 2004
A expressão “frutos do mar” é uma expressão análoga a “frutos da terra”, nome dado aos produtos obtidos da terra para alimentação do homem. Na pré-história (cerca de 4000 a.C.), o Homem vivia maioritariamente do que a Natureza lhe proporcionava, sem que isso implicasse perigo ou esforço de perseguição: por isso, os frutos, as folhas, as raízes, os insectos nas suas diversas fases de metamorfose e, evidentemente, os moluscos e crustáceos da terra e do mar fizeram parte desta dieta primordial como precioso aporte proteico. Ao criar armas, como arpões, lanças, redes de pesca, arcos, flechas e armadilhas, a sua alimentação muda (de vegetais e frutas) para uma alimentação baseada na caça. Vivia então nestes locais enquanto houvesse frutas, raízes, legumes, peixe ou caça, mas quando a comida se tornava escassa saía em busca de um novo local. O Homem torna-se desta forma nómada [6] [7].
Também na pré-história, o homem aprende a cultivar a terra e a tirar dela alimentos necessários à sua subsistência. A caça até então era praticada de modo precário; o caçador andava quilómetros para encontrar apenas o estritamente necessário para a sua alimentação. E como a população caçadora crescia, e com isso ia ocorrendo a escassez de alimentos, era preciso arranjar uma nova forma de sobrevivência. Com a agricultura, o homem passou a ter uma grande oferta de cereais na alimentação [6].
Muito mais tarde, com a revolução industrial (século XVIII), houve novamente mudanças dos hábitos de vida da população, principalmente nos alimentos consumidos. Nesta época, os homens deixaram o campo para trabalhar em indústrias e as mulheres começaram a trabalhar fora de casa. Com o passar dos anos, aumentou o consumo de alimentos ricos em gorduras (alimentos congelados ou prontos para consumo), açúcar refinado (refrigerante, guloseimas) e pobres em hidratos de carbono complexos (arroz e batata) e fibras (frutas e legumes). O Homem, desde o início dos tempos, apesar de passar de colector dos frutos da terra e das regiões aquáticas (margens de rios, lagos, costa marinha) a caçador e agricultor, sempre se manteve activo, movimentando-se em torno do seu sustento, o que não ocorre nos dias de hoje. A vida cada vez mais sedentária, a falta de exercício físico e a procura por alimentos rápidos, prontos e industrializados, trouxeram vários problemas de saúde como a obesidade, diabetes, cancro, trombose, entre outros [7].
6 Delson, E. Encyclopedia of Human Evolution and Prehistory, New York: Routledge, 2000.
7 Flandrin, J. História da Alimentação, São Paulo: Estação da Liberdade, 1998.
Apesar de toda a evolução alimentar, o Homem sempre se dedicou à actividade piscatória, como profissão, por desporto ou até mesmo por lazer. A grande extensão da costa marítima e a quantidade de rios em Portugal favoreceram bastante a actividade da pesca. Em várias localidades ribeirinhas e no litoral, a pesca constituía a principal fonte económica e em tantas outras representava um importante meio de complementação do orçamento familiar ou da alimentação. Ao longo do tempo, a pesca passou por profundas transformações. A drástica diminuição dos peixes nos rios, a poluição e diminuição das margens modificou profundamente esta actividade. Os chamados “Pesque e Pague”, da actualidade – locais com tanques de peixes onde se pode pescar mediante pagamento –, expressam muito bem o forte interesse económico nessa actividade, transformando até o lazer e a diversão da pescaria em lucrativas actividades comerciais [8].
Os povos ribeirinhos, habitualmente nas margens dos grandes rios, têm como principais atividades económicas e de subsistência a pesca e a agricultura de pequena escala, complementadas por criação de animais. Em suma, estes grupos dependem tanto da terra, para as actividades agrícolas, como da água, para desenvolverem as actividades de pesca [9].
O ciclo sazonal regula estritamente as actividades que estes povos podem fazer: as chuvas dificultam fortemente as actividades de agricultura, a lida com os animais e também impossibilita a pesca. O modo de vida destes grupos está condicionado pelo ciclo hidrológico, pois na época de enchente dos rios todas as actividades de pesca ficam comprometidas [9].
A pesca é bastante difundida nesta cultura, ocorrendo geralmente de forma mais artesanal, ou seja, utilizando barcos pequenos (ou mesmo canoas) com pouca autonomia e com tripulação reduzida. As técnicas de pesca são bastante diversificadas, incluindo redes de pesca de vários tipos, anzol e linha, espinhel (vários anzóis atados a uma corda), tarrafas e armadilhas diversas, utilizadas para capturar várias espécies de peixes, moluscos e crustáceos. Esporadicamente pode ocorrer também a caça, para fornecer proteína animal adicional, especialmente nas épocas do ano em que a pesca é dificultada por factores climáticos ou sazonais [10], [9].
A pesca artesanal em Portugal assume uma elevada importância devido à grande implantação ao longo da costa, rias, rios e lagoas. A grande variedade de espécies comestíveis com alto valor comercial, as inúmeras artes de pesca usadas e a quantidade de pessoas empregues no sector constituem uma parte sócio-económica portuguesa bastante significativa. De 1999 a 2006, segundo o Programa Operacional Pesca 2007-2013 (2007) da Direcção-Geral das Pescas e Aquicultura, houve uma redução significativa do número de embarcações em todos os segmentos (pesca artesanal, pesca costeira e pesca longínqua) [11]. Segundo a mesma fonte, Portugal possui uma extensão de costa com 2.830 km e é detentor de uma das maiores Zonas Económicas Exclusivas da União Europeia, com cerca de 1.656 mil km2, que compreende uma zona de Mar Territorial e Plataforma Continental. Em 2006, o número de embarcações da pequena pesca no continente (embarcações com menos de 12 metros) era de 6.854, existindo mais 417 na Madeira e 626 nos Açores. Este número representa cerca de 90% das embarcações nacionais. A nível regional, a maior parte das embarcações encontrava-se em 2006 registada na região centro (28%) e Algarve (26%). No que respeita às embarcações de maior potência, a região centro ocupa, também, o primeiro lugar nacional [11].
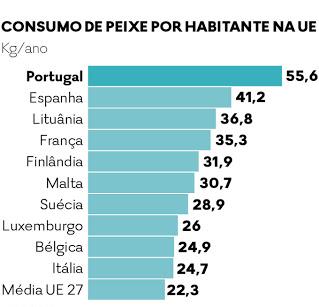
No que se refere ao consumo, Portugal aparece como o país da União Europeia que mais peixe consome (Figura 2). A nível mundial, é apenas ultrapassado por islandeses e japoneses [12] [13]. As espécies de peixe mais consumidas em Portugal são o bacalhau, o atum e a pescada e a nível europeu observa-se um maior consumo de atum, bacalhau e salmão [14].
As escolhas dos portugueses são fortemente afectadas pela religião, especialmente nos períodos da Quaresma e do Natal, onde o consumo de pescado é maior, e também pela tradição, de tal forma que o bacalhau (seco e salgado) é a espécie mais importante nos hábitos alimentares, representando mais de metade do consumo de pescado em Portugal [15].
8 Petrere, M. “Ciência Hoje: Pesque-solte: lazer ou crueldade?”, 18 12 2014. [Online]. Available: http://cienciahoje.org.br/artigo/pesque-solte-lazer-ou-crueldade/. [Acedido em Novembro 2018].
9 Begossi, A. “Ecological, cultural and economic approaches to manage small-scale artisanal fisheries”, Environment, Development and Sustainability, vol. 16, pp. 5-13, 2014.
10 Begossi, A. “Ecologia de pescadores da Mata Atlântica e da Amazônia”, Hucitec, 2ª edição, 2014.
11 “Programa Operacional Pesca 2007-2013”, Direcção-Geral das Pescas e Aquicultura do Ministério da Agricultura, do Desenvolvimento Rural e das Pescas, 2007.
12 FAO (Food and Agriculture Organization of the United Nations), “The State of World Fisheries and Aquaculture – Opportunities and challenges”, Rome, 2014.
13 Portal da Mar, “Os portugueses são o povo europeu que come mais peixe. Porquê?”, Julho 2017. [Online]. Available: http://portaldomar.blogspot.com/2017/07/os-portugueses-sao-o-povo-europeu-que.html. [Acedido em Dezembro 2018].
14 EC (European Comission), “The EU Fish market. European Market Observatory for Fisheries and Aquaculture Products (EUMOFA)”, 2014.
15 Cardoso, C. e Nunes, M. Alimentação e pescas: A importância do consumo de produtos da pesca em Portugal. In: O futuro da alimentação: ambiente, saúde e economia, Lisboa: Fundação Calouste Gulbenkian, 2013.
Entre 2001 e 2010, foram consumidos, em média, 55.6 Kg de pescado por pessoa, entre os quais, 6% de moluscos, ou seja, cerca de 3.6 Kg/per capita/ano [16]. As capturas de moluscos em Portugal no ano de 2016 atingiram 19 368 toneladas, sendo que 73 toneladas correspondem a capturas de ostras. A produção em aquicultura de moluscos gerou uma receita de 75.2 milhões de euros, tendo sido produzidos 11 259 toneladas. A produção de moluscos e crustáceos representou 56.5% do total produzido em aquicultura em Portugal, sendo o grupo mais produzido o da amêijoa, seguido pelo do mexilhão e por fim o da ostra (esta última com uma produção de 1 014 toneladas). A ostra-japonesa foi a espécie mais produzida em aquicultura em Portugal em 2016, tendo sido obtidas 633 toneladas. Da ostra-portuguesa foram produzidas 241 toneladas e 140 toneladas de outras espécies de ostras [17].
Desde a segunda metade do século passado, a abundância de stocks de ostras tem reduzido drasticamente devido à sobreexploração. Os bancos naturais de ostras formam um biótopo, com muitas espécies associadas. A perda deste habitat resultou num grande declínio na riqueza de espécies no ambiente costeiro [18].
O desenvolvimento das técnicas de incubação de ostra têm sido realizadas desde as décadas de 1960 e 1970 [19]. A investigação tem demonstrado que a reprodução de ostras em cativeiro pode ser realizada com taxas de sobrevivência relativamente altas, ultrapassando todos os obstáculos relacionados com a biologia da espécie, aspectos técnicos e legislação.
Assim, a aquicultura poderá ser uma grande valência na recuperação de stocks naturais de ostras [18].
16 Narita, D. “Economic impact of ocean acidification on shellfish production in Europe”, Journal of Environmental Planning and Management, vol. 60, nº (3), pp. 500-518, 2017.
17 INE, I.P., “Estatísticas da Pesca”, 2018. [Online]. Available: https://www.ine.pt/xportal/xmain?xpid=INE&xpgid=ine_publicacoes&PUBLICACOESpub_boui=320384843&PUBLICACOESmodo=2.
18 Laing, I. “Return of the native – is European oyster (Ostrea edulis) stock restoration in the UK feasible?”, Aquatic Living Resources, nº 19(3), pp. 283-287, 2006.
19 Walne, P. “Experiments on the growth and food conversion efficiency of the spat of Ostrea edulis L in a recirculation system”, ICES Journal of Marine Science, nº 35(3), pp. 303-318, 1974.
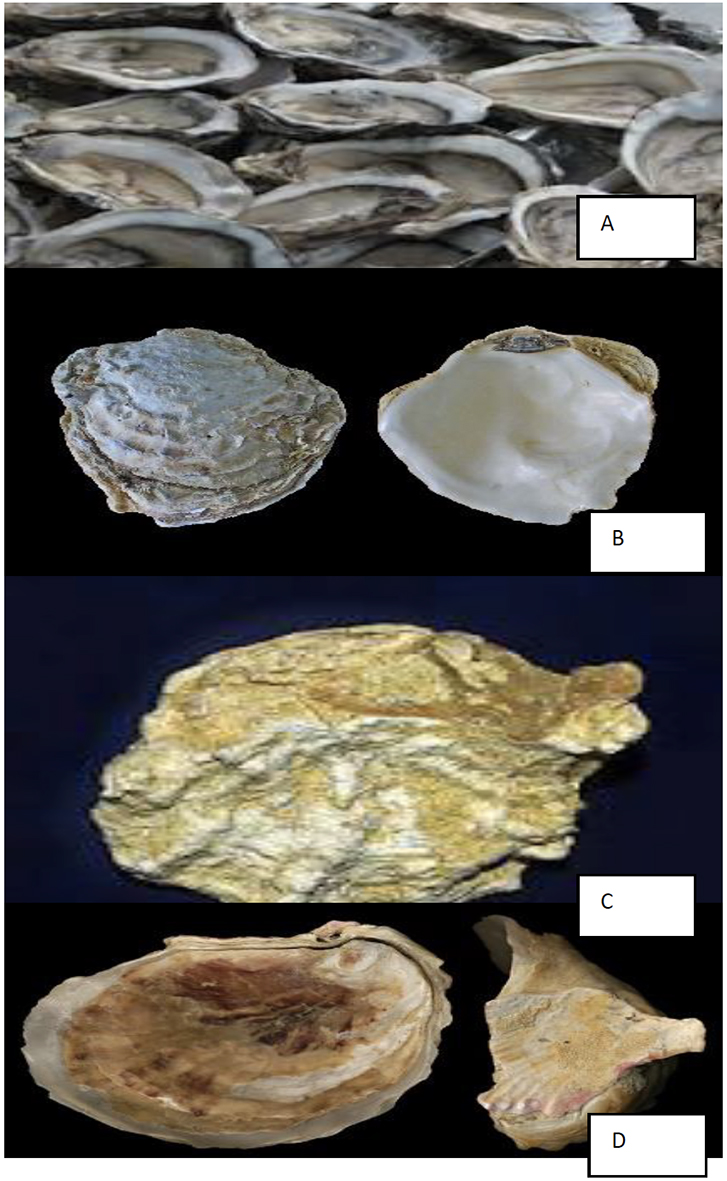
Figura 3:
(A) Crassostrea angulata (ostra-portuguesa),
(B) Ostrea edulis (ostra-plana)
(C) Ostrea stentina (ostra-anã)
(D) Ostrea cochlear
Em Portugal, existem quatro espécies de ostra, Crassostrea angulata (ostra-portuguesa) (A), Ostrea edulis (ostra-plana) (Figura 3B), Ostrea stentina (ostra-anã) (Figura 3C) e Ostrea cochlear (Figura 3D). Contudo, devido às suas características, apenas O. edulis e C. angulata são exploradas comercialmente [20]. A ostra-portuguesa (Crassostrea angulata) é um molusco bivalve popularmente conhecido como carcanhola. Assume uma notável importância mundial a nível económico, gastronómico e ecológico, sendo ainda um bioindicador relevante para a qualidade ambiental [21]. A distribuição geográfica da ostra-portuguesa está centrada nos estuários e rias desde a zona centro de Portugal continental até à costa de Marrocos, com grande incidência no estuário do Sado, existindo também no Sul de Espanha [22].
20 Ruano, R. “Fisheries and farming of important bivalves in Portugal”, NOAA Tech. Rep. NMFS, vol. 129, pp. 191-220, 1997.
21 Cross, I. “Adaptation to abiotic stress in the oyster Crassostrea angulata relays on genetic polymorphisms”, Fish and Shellfish Immunology, vol. 41, nº 2, pp. 618-624, 2014.
22 Silva, H. “Morfologia, Biologia e Ecologia dos Moluscos Bivalves in Silva, H. A. e Batista, I.”, em Produção, Salubridade e Comercialização de Moluscos Bivalves em Portugal, vol. Publicações Avulsas do IPIMAR, Lisboa, Publicações Avulsas do IPIMAR, 2008.
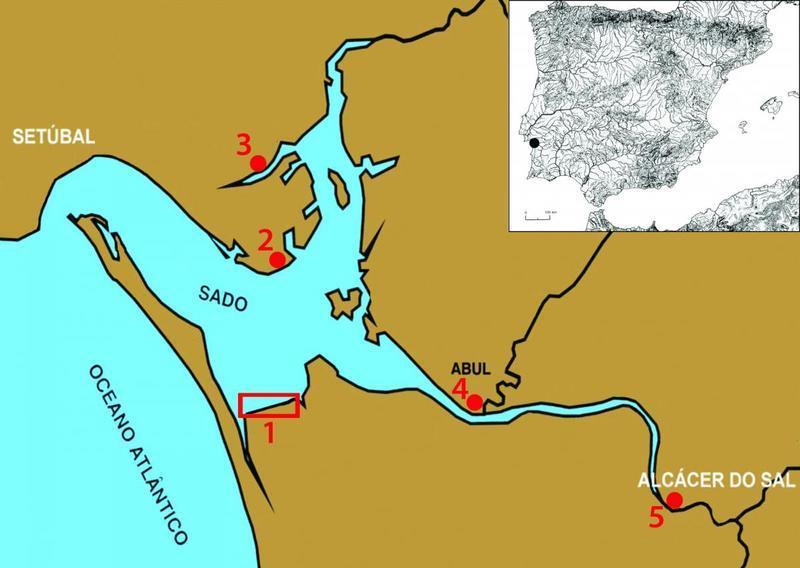
Devido à sua situação geográfica, ao lado do rio Sado (Figura 4), Setúbal foi uma cidade com grande potencial para a exploração de recursos marinhos. A pesca sempre foi uma actividade de grande relevo ao longo dos séculos, pelo que os bairros de pescadores se foram formando fora do burgo medieval. Um dos principais eventos de Setúbal é o Festival da Ostra, com o objectivo de divulgar sabores e tradições da cozinha setubalense, fazendo da ostra um fruto do mar muito emblemático da região [23].
Assim sendo, na primeira parte desta dissertação, o objectivo principal é a identificação e caracterização da ostra-portuguesa e desenvolvimento da espécie, bem como a história da sua produção, consumo e confecção. A segunda parte foca-se na ostra como um fruto da região de Setúbal e a sua contextualização histórica até aos dias de hoje: desde a ocupação romana, os seus hábitos alimentares, o comércio da ostra na região e a actual elitização da ostra. A terceira parte desta dissertação de mestrado aborda a ostra na identidade da região de Setúbal, actividades económicas da população (agricultura, pesca e turismo) e outros produtos, para além da ostra, característicos deste território [23].
23 Silva, J. Setúbal, Lisboa: Editorial Presença, 1990.
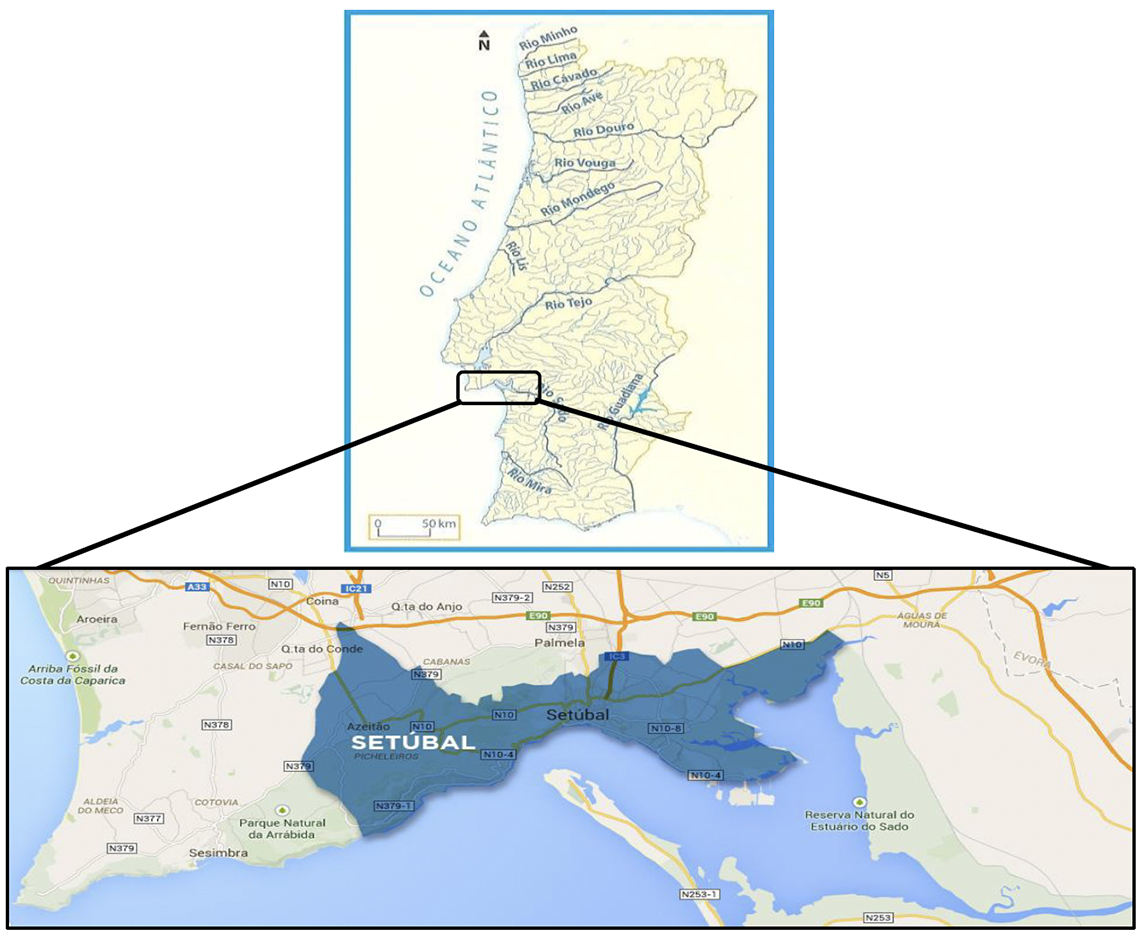
Figura 4: Localização geográfica da região de Setúbal
O crescimento mundial da população tem como consequência um aumento da procura de alimento. Nesse sentido, a aquicultura tem desempenhado, desde a década de 50 do século passado, o papel de actividade agroalimentar capaz de suprir essa procura. A partir dessa década, a média de crescimento anual da aquicultura global situa-se nos 7%. Comparativamente com outras áreas de produção agroalimentar, como a indústria pesqueira, que desde os anos 1990 vêm apresentando um crescimento médio de 1,4%, ou a produção de animais terrestres, que, no mesmo período, se traduz numa média de crescimento em torno de 2,8% [24].
A aquicultura no mesmo período apresenta uma média de crescimento de aproximadamente 9%, o que torna esta actividade uma fonte potencial e de extrema importância para a satisfação da procura global por alimento, particularmente na Ásia, onde a aquicultura está enraizada nas estratégias de produção alimentar desde há séculos e hoje continua, também devido à pressão demográfica e esgotamento dos espaços naturais disponíveis. [24].
Actualmente, a aquicultura é responsável por sensivelmente 40% do total da produção de organismos aquáticos, sendo que o restante ainda provém da pesca extractiva (Figura 5). Tendo em conta a actual situação de sobreexploração de muitos dos stocks de diversas espécies de peixes e outros organismos aquáticos, a tendência da produção em aquicultura, ao longo do tempo, é para aumentar [12] [24].
Na década de 50 do século passado, a produção em aquicultura situava-se em um milhão de toneladas por ano. Segundo as estatísticas da FAO, em 2010, a produção em aquicultura foi de 59,9 milhões de toneladas e a produção proveniente da pesca extractiva correspondeu a 88,6 milhões de toneladas, totalizando uma produção de 148,5 milhões de toneladas [24].
Assumindo o actual ritmo de crescimento da população humana, assim como a consequente demanda por alimento e o rápido declínio dos stocks pesqueiros, que têm como efeito a diminuição da produção proveniente da pesca extractiva, estima-se, segundo a Food and Agriculture Organization of the United Nations (FAO), que em 2050 a produção em aquicultura necessitará atingir os 80 milhões de toneladas. Desta forma, supõe-se que o actual ritmo de crescimento da produção em aquicultura deverá manter-se ou até mesmo aumentar ao longo das próximas décadas [12].
Em aquicultura são produzidas as mais diversas espécies de organismos aquáticos, nomeadamente os peixes de água doce, que representam o grupo de organismos com maior produção, quase 34 milhões de toneladas em 2010, as plantas aquáticas, os moluscos, que tiveram uma produção de cerca de 14 milhões de toneladas em 2010 e que fazem deste o terceiro maior grupo de organismos produzidos em aquicultura (ultrapassado pelas plantas aquáticas, que tiveram uma produção de cerca de 19 milhões de toneladas em 2010), peixes diádromos, peixes marinhos e crustáceos [12].
24 FAO, “Global aquaculture production 1950-2010”, Fisheries Global information system, 2016.
25 Gomes, C. “Ciclo reprodutivo da ostra Crassostrea brasiliana (Lamarck, 1819) em cultivo e maturação em laboratório”, Dissertação de mestrado apresentada ao programa de Pós-graduação em Aquicultura, do Centro de Ciências Agrárias da Universidade Federal de Santa Catarina.
A ostra-portuguesa é uma espécie de ostra encontrada frequentemente na Península Ibérica e muito semelhante à ostra-do-pacífico (Figura 6: Ostra-portuguesa, Crassostrea angulat). Pode ser encontrada em águas poucos profundas e em viveiros quando em produção extensiva [30]. A classificação científica desta espécie está descrita na Tabela 1.
A concha é constituída principalmente por carbonato de cálcio, que é retirado directamente da água do mar com auxílio de células especializadas localizadas no manto. São animais de corpo mole, lateralmente comprimidos e compostos de duas válvulas articuladas e um potente músculo adutor [26]. A forma e cor da concha da ostra-portuguesa podem ser um pouco variáveis, devido ao tipo de substrato em que está inserida. As ostras que crescem em substratos moles têm geralmente menos lâminas do que as que se desenvolvem em substratos duros. O seu interior é branco, com uma mancha escura perto da ligação do músculo adutor. O corpo é coberto por um tegumento designado “manto”, que está também envolvido no processo de calcificação da concha. Entre os dois lados deste, encontra-se a cavidade palial, um espaço livre dividido pelas brânquias, onde existe a circulação da água através de um processo inalante e exalante (não existe sifão), do qual se obtém o processo de respiração e alimentação.
30 Eble, A. “General anatomy. The eastern oyster Crassostrea virginica”, Edited by Maryland sea Grant College, University of Maryland System, College Park, 1996.
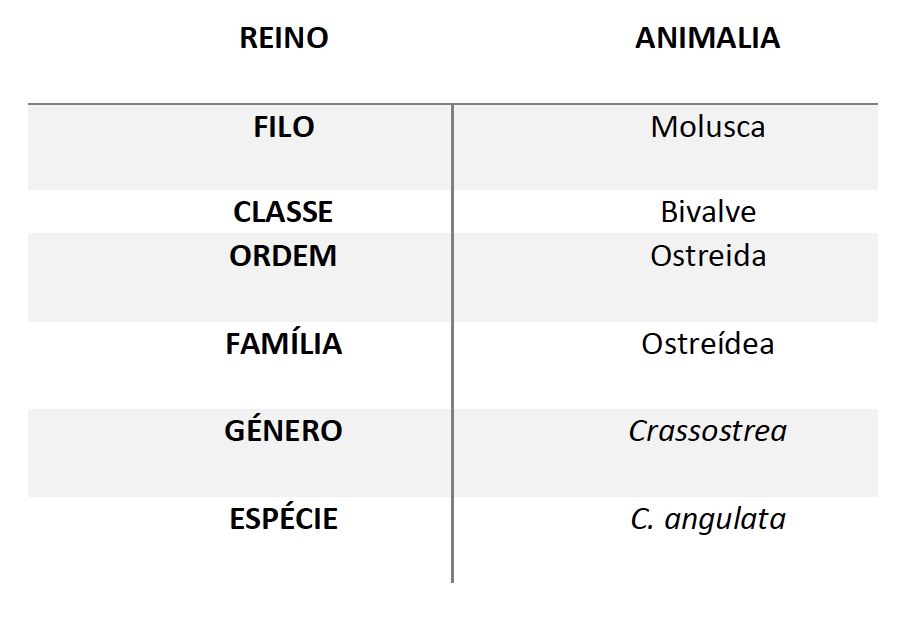
Tabela 1: Taxonomia da ostra-portuguesa (Lamarck, 1819).

Figura 6: Ostra-portuguesa, Crassostrea angulata.
Durante a fase de reprodução, as gónadas ocupam quase toda a totalidade do corpo do animal.
A ostra-portuguesa tem um gancho atrás do ligamento na valva superior e coloração violeta das impressões dos músculos adutores. Através da concha, é possível distingui-la da Ostrea edulis (ostra-plana), devido à sua conformação externa, o seu menor número de pregas ou dobras na valva superior e as manchas violeta. A ostra-plana tem as impressões musculares brancas, como o resto do interior das valvas, e o número das dobras da valva inferior é muito maior (Figura 8) [32].
Quanto à reprodução, a ostra-plana é hermafrodita e os seus ovos são fecundados e desenvolvidos dentro do corpo da mãe; já a ostra-portuguesa é unissexuada e os seus ovos são fecundados fora do corpo do molusco, na água ambiente [33].
31 Bacca, H. “Etude des voies metaboliques des sucres chez l’huitre creuse Crassostrea gigas. Implication dans les Mortalités estivales”, IFREMER/Université de Rennes, France, 2007.
32 Ferreira, I. “Crescimento e qualidade da ostra (Crassostrea gigas) em viveiros da Ria Formosa sujeitos a diferentes condições de cultura e situações ambientais”, Dissertação apresentada ao Instituto de Ciências Biomédicas de Abel Salazar para obtenção do grau de mestre em Ciências do Mar – Recursos Marinhos, especialidade de Aquacultura, Porto, 2003.
33 Wang, J. “A High-Density SNP Genetic Linkage Map and QTL Analysis of Growth-Related Traits in a Hybrid Family of Oysters (Crassostrea gigas × Crassostrea angulata) Using Genotyping-by-Sequencing”, G3: GENES, GENOMES, GENETICS, vol. 6, nº 5, pp. 1417-1426, 2016.
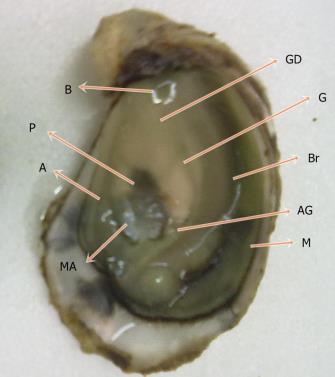
Figura 7: Anatomia da C. angulata (adaptado Vilela 1975): A -Ânus; AG -Abertura Urino-Genital; B -Boca; Br -Brânquias; P -Pericárdio; GD -Glândula Digestiva; G -Gónada; M -Manto; MA -Músculo Adutor.
Estudos genéticos mostram que a ostra-portuguesa é originária da Ásia e foi introduzida na Europa através das trocas de mercadoria de navios no século XVI. A ostra-portuguesa foi inicialmente descrita por Lamarck como sendo um endemismo da Península Ibérica. Pensava-se que teria sido introduzida na região francesa de Arcachon em 1867 como uma nova espécie para aquicultura e que, devido ao elevado sucesso, se expandira por toda a França e um pouco por toda a Europa. Só recentemente é que foram identificadas populações de C. angulata em Taiwan, de onde se pensa que esta será originária [34]. Estudos usando marcadores mitocondriais reportam a presença de populações “puras” desta espécie em Taiwan. Assim é de supor uma origem asiática, que provavelmente é um caso de introdução antropogénica (premeditada ou não) na Europa [35]. Hoje em dia, esta espécie pode também ser encontrada em Portugal, Espanha e costa atlântica de Marrocos [36].
As ostras ocupam dois tipos de biótopos em função do seu estado de desenvolvimento. Os embriões e as primeiras fases larvares têm um estado plantónico, e os juvenis e adultos são bentónicos. Fixam-se maioritariamente em substratos duros ou lodosos, ao nível das zonas litorais e podem ser encontradas geralmente em estuários, rias e lagoas, por vezes afastadas vários quilómetros da foz. Esta espécie apresenta uma grande tolerância às variáveis ambientais, resistindo a grandes amplitudes térmicas e salinidade [37]. A C. angulata, como outros bivalves, são animais filtradores. Alimentam-se de fitoplâncton, bactérias, larvas de invertebrados e detritos suspensos na coluna de água [33].

Figura 8: Espécies de ostra nativas do litoral português. Vista posterior / concha direita. Retirado de [82].
A alimentação ocorre filtrando grandes quantidades de água, pelas brânquias, eliminando partículas de maiores dimensões (1-10 μm). Uma ostra de tamanho médio pode filtrar 30 L/hora e este método de alimentação permite absorver os nutrientes e eliminar na forma de pseudofezes as partículas sem interesse para a sua nutrição [38].
As partículas efectivamente ingeridas são conduzidas para o estômago coberto de cílios e muco, onde se produz uma trituração mecânica e enzimática (amilase, laminariase, celulase). É comum a presença de grãos de areia no interior do estômago, de modo a facilitar a “trituração” do alimento [34].
O estômago está ligado à glândula digestiva através canais que se ramificam em túbulos, nos quais continua a digestão intracelular por fagocitose e por enzimas lisossomáticas. Os resíduos da digestão seguem por um intestino, no qual ainda ocorre a absorção de nutrientes até serem expelidos através do ânus [39].
A ostra C. angulata é um animal do tipo hermafrodita irregular alternado, que ocorre normalmente como macho na sua primeira maturação sexual, alternando de sexo supostamente de dois em dois anos. No entanto, existe uma baixa frequência (entre 0 e 3%) de indivíduos que podem apresentar hermafroditismo simultâneo [33]. O rácio sexual é geralmente de 1 fêmea para 1 macho (1:1); porém, este factor está intimamente correlacionado com as condicionantes ambientais e o factor demográfico da população. As ostras apresentam um sistema reprodutivo simples, tanto na função como na estrutura. Ambos os sexos têm as gónadas constituídas por uma rede de folículos, as quais abrem na câmara exalante através de dois poros genitais localizados sobre as brânquias [40]. O aparelho reprodutivo está localizado na região gonadal, entre a glândula digestiva e o manto. Este é constituído por tubos, mais ou menos desenvolvidos, dependendo da fase da gametogénese. Na maturidade sexual, os tubos gonadais ocupam toda a região da gónada e esta torna-se mais clara. De uma forma geral, a reprodução marca-se por cinco fases: no Outono, um estado de repouso marcado pela reorganização do tecido gonadal; no Inverno e Primavera, a fase de multiplicação das células germinativas por mitoses sucessivas; fase de desenvolvimento e maturação das gâmetas; na Primavera-Verão, as gâmetas maduras são emitidas por sucessivas posturas na água; por fim, ocorre uma fase de absorção das gâmetas não emitidas após as posturas. Contudo, o ciclo reprodutivo dos bivalves varia consoante a temperatura da água e o alimento disponível [41].
A reprodução nesta espécie é externa, gâmetas masculinos e femininos são libertados diretamente para o meio e a fecundação acontece na coluna de água. A fêmea pode produzir facilmente 50 a 100 milhões de ovos (com diâmetros entre 50 e 60 μm) durante uma época. Após a fertilização, o ovo desenvolve-se gradualmente, tendo o seu início em mórula, blástula, gástrula, larva trocófora e larva velígera (larva D) (Figura 9). Gradualmente, estas vão-se desenvolvendo, transformando-se em larvas pedivelígeras, com o surgimento das brânquias e de um sistema nervoso visível. Nesta fase, as larvas iniciam o processo de fixação ao substrato, sofrendo uma metamorfose que leva a uma reorganização completa do animal. A fixação ocorre, geralmente, em conchas de outras ostras, o que pode indicar que são libertadas feromonas por parte dos adultos e/ou dos juvenis [31]. Contudo, as larvas podem fixar-se a outros substratos [33].
34 Boudry, P. “Differentiation between populations of the Portuguese oyster, Crassostrea angulata (Lamark) and the Pacific oyster, Crassostrea gigas (Thunberg) revealed by mtDNA RFLP analysis”, J. Exp. Mar. Biol. Ecol., nº 226, pp. 279-291.
35 Batista, F. “Assessment of the aquacultural potential of the Portuguese oyster Crassostrea angulata”, Instituto de Ciências Biomédicas Abel Salazar, Porto, 2007.
36 Fabioux, C. “Past and present geographical distribution of populations of Portuguese (Crassostrea angulata) and Pacific (C. gigas) oysters along the European and north African Atlantic coasts”, Haliotis, nº 31, pp. 33-34, 2002.
37 Vilela, H. “A respeito de ostras – Biologia – Exploração – Salubridade”, Notas e Estudos da Secretaria de Estado das Pescas, Série – Recursos e Ambiente Aquáticos Nº1. Serviço de Publicações e Comunicações do Gabinete de Coordenação da SEP, Lisboa, 1975.
38 Hawkins, A. “Some general relationships in comparing the feeding phisiology of suspension-feeding bivalve molluscs”, J. Exp.Mar. Biol. Ecol., nº 2019, pp.-87-103,1998.
39 Diederich, S. Introduced Pacific oysters (Crassostrea gigas) in the northern Wadden Sea: invasion accelerated by warm summers. Helgol. Mar. Res (59), 97-106. (2005)
40 Walne, P. (s.d.). Culture of Bivalve Molluscs: Fifty years Experience at Conwy. Whitefriars Press, London. 173p.
De um modo geral, as características microbiológicas de moluscos variam de acordo com as localizações geográficas dos cultivos, diferentes habitats, método de produção, práticas de manejo, condições ambientais e procedimentos pós-colheita. O estado microbiológico de ostras após a colheita está directamente relacionado com a qualidade microbiológica da água, que é influenciada também pela temperatura e salinidade da água, distância entre o local de cultivo e áreas poluídas com material fecal (próximas da costa, descarga de esgoto, etc.) ou à ocorrência de bactérias naturalmente presentes na água [42] Por isso, a qualidade sanitária das águas de cultivo de moluscos é um aspecto imprescindível para a obtenção de um produto seguro [43].
Do estatuto sanitário, associado à aquacultura de bivalves, vamos dar especial atenção à contaminação bacteriológica, especificamente as bactérias Escherichia coli, os coliformes totais e os coliformes fecais. A presença de E. coli e outros coliformes fecais em alimentos está directamente relacionada com a contaminação fecal. (ver nota 33)
A medição dos coliformes é habitualmente utilizada para determinar a qualidade sanitária de águas para beber e actividades recreativas e para a avaliação do estatuto sanitário em moluscos. [44].
Os coliformes totais definem-se como bactérias com forma de bacilo, Gram-negativas, não esporogénicas, aeróbias e anaeróbias facultativas, capazes de fermentar a lactose com produção de gás dentro de 24-48h a 35°C. Os coliformes fecais, também denominados termotolerantes, por suportarem uma temperatura superior a 40°C, que fermentam a lactose com produção de ácido e gás em 24h a 44.5–45.5°C, são específicos das fezes de animais homeotérmicos e considerados como indicadores de contaminação [45].
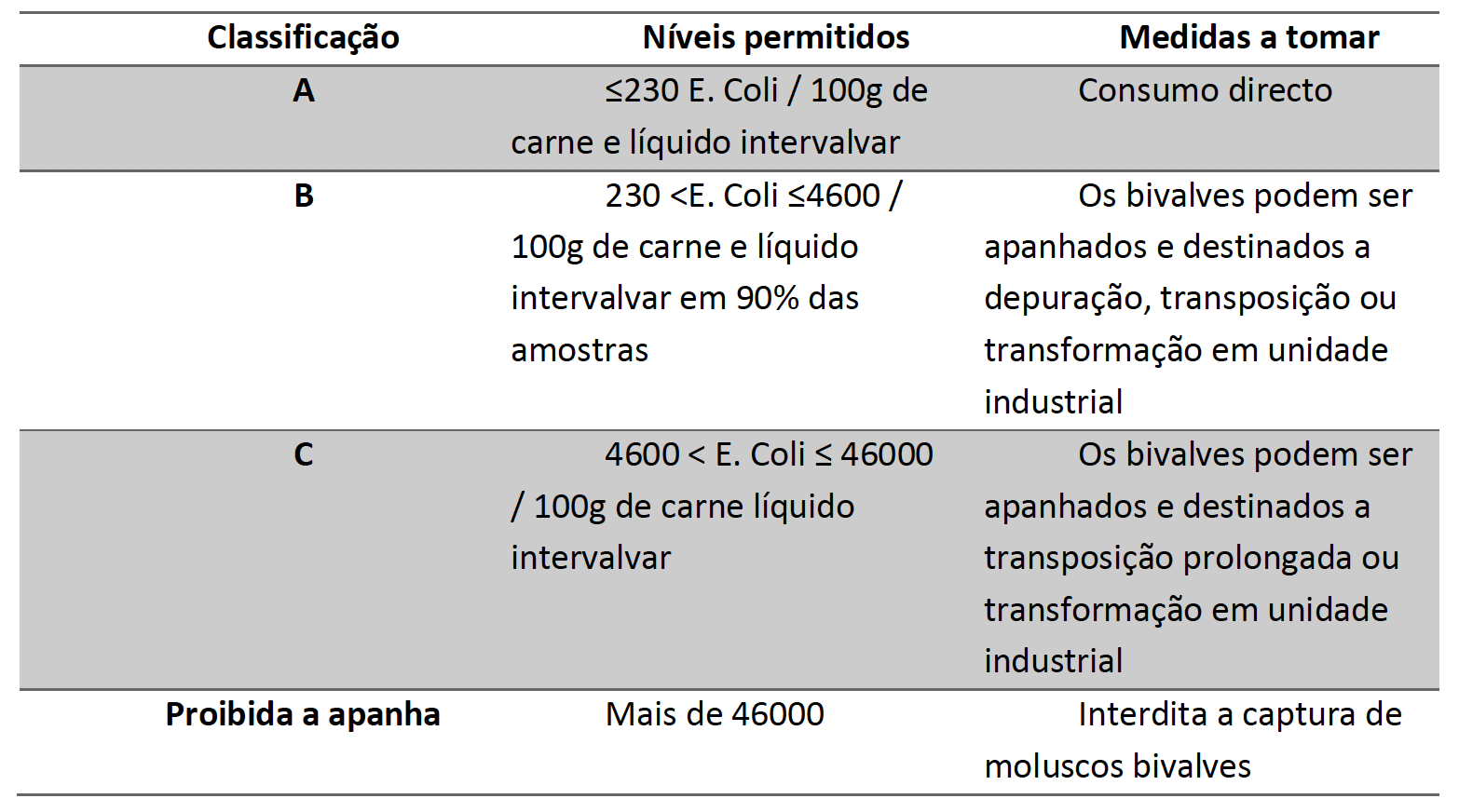
A espécie E. coli, que, dentro das bactérias pertencentes ao grupo dos coliformes fecais, é a única que geralmente não se reproduz nem cresce no meio ambiente, decorre especificamente da contaminação fecal e, por consequência, é o melhor indicador de contaminações fecais, sendo aliás a espécie utilizada para avaliar o estatuto sanitário tanto de águas como de moluscos [46]. Foi publicado no Despacho nº 15264/2013, que estabelece as normas sanitárias que regem a produção e a colocação no mercado de moluscos bivalves vivos. Segundo este documento, as zonas de produção/apanha de bivalves podem ser classificadas de A, B, C e classe proibida, incluindo também as medidas a tomar para cada estatuto, como pode ser observado na Tabela 2 [47].
42 Leão, G. (2016). Condições ambientais e nutricionais no crescimento em berçário de juvenis de ostra (Crassostrea spp.). Tese para obtenção do Grau Mestre em Aquacultura e Pescas – Universidade do Algarve.
43 Costa, R. (2013). Escherichia coli in seafood: A brief overview. Advances in Bioscience and Biotechnology, 4, 450-454.
44 Dionísio, L. (1996). Estudos microbiológicos da Ria Formosa. Qualidade sanitária de águas e moluscos bivalves. Dissertação apresentada à Universidade do Algarve para obtenção do grau de Doutor em Ciências Biológicas, na especialidade de Microbiologia. Faro. Universidade do Algarve.
45 Bonde, G. (1968) “Bacterial indicators of water pollution: a study of quantitative estimation”, 2nd ed. Teknisk Forlag, Copenhagen.
46 Souza, N. (2010) “Desenvolvimento de um imunossensor para detecção de Escherichia coli em água”, Dissertação apresentada à Escola de Química, para obtenção do Grau de Mestre em Ciências. Rio de Janeiro: Escola de Química da Universidade Federal do Rio de Janeiro.
47 Ministério da Saúde, “Diário da República, 2.ª série — Nº 227 — 22 de novembro de 2013”, 2013. [Online]. Available: https://www.ipma.pt/export/sites/ipma/bin/docs/institucionais/desp.15264.2013_zonas.pdf. [Acedido em Dezembro 2018].
Figura 9: Ciclo de crescimento de C. angulata: 1 -fase adulta; 2 -fecundação; 3 -início da divisão celular; 4 -larva trocófora; 5 -larva velígera (larvaD);6 -larva umbulada; 7 -larva em metamorfose; 8 -juvenil

Tabela 2: Escala de classificação do estatuto sanitário das ostras
E. coli é uma bactéria que vive na camada mucosa do cólon de animais de sangue quente. Estas bactérias são a microbiota facultativa não-patogénica predominante no intestino humano. No entanto, algumas estirpes de E. coli desenvolveram a capacidade de causar doenças gastrointestinais, urinárias ou no sistema nervoso central, mesmo em hospedeiros humanos mais robustos [48]. Estas contaminações podem ser originadas de duas formas: pelo contacto directo com o produto com as mãos contaminadas ou pela existência destes organismos no meio marinho. Para prevenir surtos de doenças associados ao consumo de moluscos, tem de haver um controlo minucioso das suas características microbiológicas [39].
A monitorização das concentrações de E. coli e outros coliformes fecais nestes invertebrados representa a forma mais directa de avaliar o estado sanitário de uma área de colheita, sendo esta uma das actividades realizadas semanalmente pelo IPMA, de forma a classificar a qualidade das zonas de colheitas de bivalves. Esta espécie de bactéria pode também ser usada para classificar o estatuto sanitário de novas áreas de interesse para a instalação de aquiculturas e, caso não existam moluscos nestas zonas, a avaliação poderá ser feita utilizando os sedimentos, verificando assim a presença ou ausência de E. coli, de forma a fornecer dados dos níveis de contaminação da nova área de interesse [49].
Uma revisão sobre a existência de E. coli em moluscos, a sua importância no estatuto sanitário e o impacto desta bactéria na saúde pública concluiu que a presença de E. coli nos alimentos provenientes do mar representa um risco para os consumidores. Este está relacionado com as estirpes patogénicas, que provocam dores de estômago e abdominais, vómitos, anorexia e, especialmente, diarreia (algumas vezes com a presença de sangue) [39].
De forma a assegurar que os alimentos provenientes do mar não se tornem num veículo de transmissão de E. coli, algumas medidas têm de ser consideradas [39], nomeadamente:
Manutenção da qualidade microbiológica da água no sítio da captura;
Cuidados pós-captura;
Condições de higiene adequada no processo de manuseamento dos animais;
No caso de comida processada, devem ser tomadas medidas para assegurar a não contaminação durante o processo.
A presença de E. coli não-patogénica, por sua vez, também deve ser levada em consideração para a saúde humana, tanto pela possibilidade da presença de estirpes patogénicas, como também por estas bactérias serem indicadoras de contaminação fecal, indicando a possível presença de outros agentes patogénicos no ambiente analisado [39].
Uma equipa de investigação fez uma monitorização da microbiologia de bivalves na ria Formosa durante um período de 20 anos (1990-2009). Verificaram que nos anos 1990 o nível de contaminação de E. coli era maior devido às descargas de águas residuais não tratadas e escorrências, pelas águas das chuvas, de produtos provenientes da agricultura. A partir do ano 2000, esta contaminação diminuiu devido à instalação ou remodelação de centrais de tratamento de águas residuais, que serviam cerca de 83% da população. Observaram também que a maior contaminação de bivalves encontrava-se nas maiores zonas urbanas (no caso deste
estudo, em Faro) devido ao facto de ainda existirem contaminações pontuais e zonas de difusão de contaminantes [50].
A contaminação das águas por E. coli pode ser influenciada por vários parâmetros abióticos. Existem diversos estudos que demonstram que as taxas de sobrevivência e desenvolvimento de bactérias nas massas de água podem ser afectadas por factores abióticos como a exposição à luz solar, temperatura, salinidade, pH, precipitação, presença de nutrientes orgânicos e inorgânicos e sedimentação [51].
Um estudo na ria Formosa demonstrou que o aumento da contaminação microbiológica geralmente era acompanhado pelo aumento da precipitação e uma diminuição da temperatura e salinidade da água. Também foi observada uma variação sazonal. Os maiores níveis de contaminação registados ocorreram durante o Outono e o Inverno, devido às escorrências das águas das chuvas. Os menores níveis de contaminação microbiológica foram registados na Primavera e no Verão, quando as elevadas temperatura e salinidade demonstraram um efeito de bactericida. Para se desenvolverem, as bactérias da espécie E. coli necessitam de salinidades baixas, temperaturas não muito elevadas, pH ligeiramente ácido (≈5), baixo período de exposição à luz solar [46].
Outros organismos potencialmente patogénicos para os humanos são as bactérias Gram-negativas Vibrio spp. Entre os membros do género, 12 espécies já foram relatadas como patogénicas para os seres humanos, onde oito destas podem ser associadas a gastroenterites de origem alimentar. A maioria das infecções alimentares são causadas pelas espécies Vibrio parahaemolyticus e Vibrio cholerae e em menor quantidade por Vibrio vulnificus [52].
Existem vários factores que podem mudar o ambiente estuarino e influenciar a comunidade microbiana, incluindo Vibrio spp., como a temperatura, a renovação da água pelas marés, o clima, a precipitação e a renovação de nutrientes, afectando a qualidade da água estuarina e a saúde pública [53]. Vários autores verificaram existir uma correlação entre a ocorrência de Vibrio spp. no ambiente, a temperatura e a salinidade [49], [54]. Estas bactérias são
originárias de habitats marinhos, salubres e estuarinos, aparecendo em grandes concentrações com temperaturas entre 20 e 30°C [49]. A baixas temperaturas, a Vibrio spp. permanece nos sedimentos do fundo do mar em concentração insuficiente para causar infecções. A sua concentração aumenta nos meses quentes devido às condições ecológicas favoráveis, aumentando a sua acumulação pelos moluscos filtradores. Relativamente à salinidade, esta é amplamente referida como tendo influências significativas na concentração de Vibrio spp. No entanto, têm sido observados vários tipos de correlações, como positiva, negativa e inexistente. Estas correlações são provavelmente afectadas pela gama de salinidades observadas [55].
Outras evidências indicam que a tolerância à salinidade pode depender da temperatura e concentração de nutrientes elevada. Sendo estas bactérias prejudiciais para os seres humanos, o regulamento (CE) nº 2073/2005 da comissão de 15 de Novembro de 2005 relativo a critérios microbiológicos aplicáveis aos géneros alimentícios não inclui critérios microbiológicos para bactérias autóctones [56].
48Nataro, J. (1998 “Diarrheagenic Escherichia coli”, Clinical Microbiology Reviews, vol. 11, nº 2, p. 403.
49 Sonier, R. (2008) “Concentration of Escherichia coli in sediments as an indicator of the sanitary status of oyster (Crassostrea virginica) aquaculture sites”, Journal of Applied Ichthyology, vol. 24, nº 6, pp. 678-684.
50 Almeida, C e Soares, F. (2012) “Microbiological monitoring of bivalves from the Ria Formosa Lagoon (south coast of Portugal): A 20 years of sanitary survey”, Marine Pollution Bulletin, vol. 64, pp. 252-262.
51 Rozen, Y. e Belkins, S. (2001) “Survival of enteric bacteria in seawater”, FEMS Microbiology Reviews, vol. 25, pp. 513-529.
52 FAO/WHO,(2004) “Joint FAO/WHO Activities on Risk Assessment of Microbiological Hazards in Foods. Preliminary Document. Hazard Identification, Exposure Assessment and Hazard Characterization of Vibrio spp”, SeaFood.
53 Hsieh, J. (2008) “Dynamics and predictive modelling of Vibrio spp”, Neuse River Estuary, North Carolina, USA. Environmental Microbiology, vol. 10, nº 1, pp. 57-64.
54 Anacleto, P. “Microbiological composition of native and exotic clams from Tagus estuary: Effect of season and environmental parameters”, Marine Pollution Bulletin, vol. 74, pp. 116-124, 2013
Os parasitas vivem em associação íntima com o seu hospedeiro, do qual dependem metabolicamente e ao qual causam danos. Estes danos podem levar o hospedeiro ao estado de doença [57].
Os principais agentes causadores de doenças em bivalves marinhos pertencem ao grupo dos vírus, bactérias, fungos, protozoários, tremátodes digenéticos, poliquetas e copépodes [58]. De entre estes parasitas, tem-se vindo a dar grande atenção aos poliquetas, uma vez que estes poliquetas (Polychaeta: Spionidae) pertencentes ao género Polydora são conhecidos pelas suas actividades em vários substratos calcários de diversas espécies, como algas coralinas, corais, conchas de moluscos e crustáceos [59].
Embora estas espécies escavem as estruturas calcárias para criação do seu habitat, são considerados invasores nocivos do ponto de vista dos aquicultores, uma vez que frequentemente afectam o valor comercial dos moluscos, tanto a nível da concha, tornando-a menos atractiva visualmente, como reduzindo a sua taxa de crescimento e quantidade de carne [60] [61].
Quando as galerias escavadas por estas espécies atingem o manto das ostras, estas reagem depositando camadas de conchiolina e calcita como forma de defesa. O poliqueta por sua vez preenche estas camadas com lodo, causando o mau aspecto nas ostras quando abertas para consumo. Embora estas espécies de parasitas não causem normalmente grandes mortalidades, afectam o crescimento das ostras pelo desvio da energia que deveria ser usada para o crescimento, para a produção de conchiolina e calcite, para se defender da invasão do mesmo e tornando estes organismos menos apelativos a nível visual, prejudicando assim o seu valor comercial [62].
55 Motes, M. (1998) “Influence of water temperature and salinity on Vibrio vulnificus in Northern Gulf and Atlantic Coast oysters (Crassostrea virginica)”, Applied and Environmental Microbiology, nº 64, pp. 1459-1465.
56 Tantillo,(2004) “Updated perspectives on emerging Vibrios associated with human infections”, Letters in Applied Microbiology, vol. 39, pp. 117-126.
57 Anderson, I. (1979) “Sublethel stress in Escherichia coli: a function of salinity”, Applied and Environmental Microbiology, vol. 38, pp. 1147-1152.
58 Kinne, O. (1983) “Diseases of marine animals”, Hamburg, Biologische Anstalt Helgoland, pp. 467-475.
59 Blake, J. “Family Spionidae Grube”, 1850. In BLAKE, J.A.; HILBIG, B.; SCOTT, P.H. (Eds.). “The Annelida, Part 3. Polychaeta: Orbiniidae to Cossuridae Santa Barbara”,SantBarbara Museum of Natural History: 81-224.
Na pré-história, a exploração ostreícola consistia na apanha destes moluscos do meio natural para consumo momentâneo e, muito raramente, para os colocar em zonas mais acessíveis, facilitando a apanha. No primeiro século antes de Cristo, Sergius Orata, um procônsul do Império Romano, criou os primeiros “parques ostreícolas” em Nápoles. Estes situavam-se nos lagos de Lucrino e de Fusaro e recebiam ostras de diferentes zonas da Europa. Posteriormente, há relatos acerca do cultivo de ostras noutros locais de Itália, Turquia, Inglaterra, Países Baixos, França, Espanha e nos países nórdicos, mas nestes últimos sem grande sucesso devido às condições ambientais menos favoráveis destas regiões [33]. O cultivo mundial de ostras tem vindo a aumentar, de poucas centenas de milhares, em 1950, a milhões de toneladas por ano desde 1984 até ao presente. (ver nota 24)
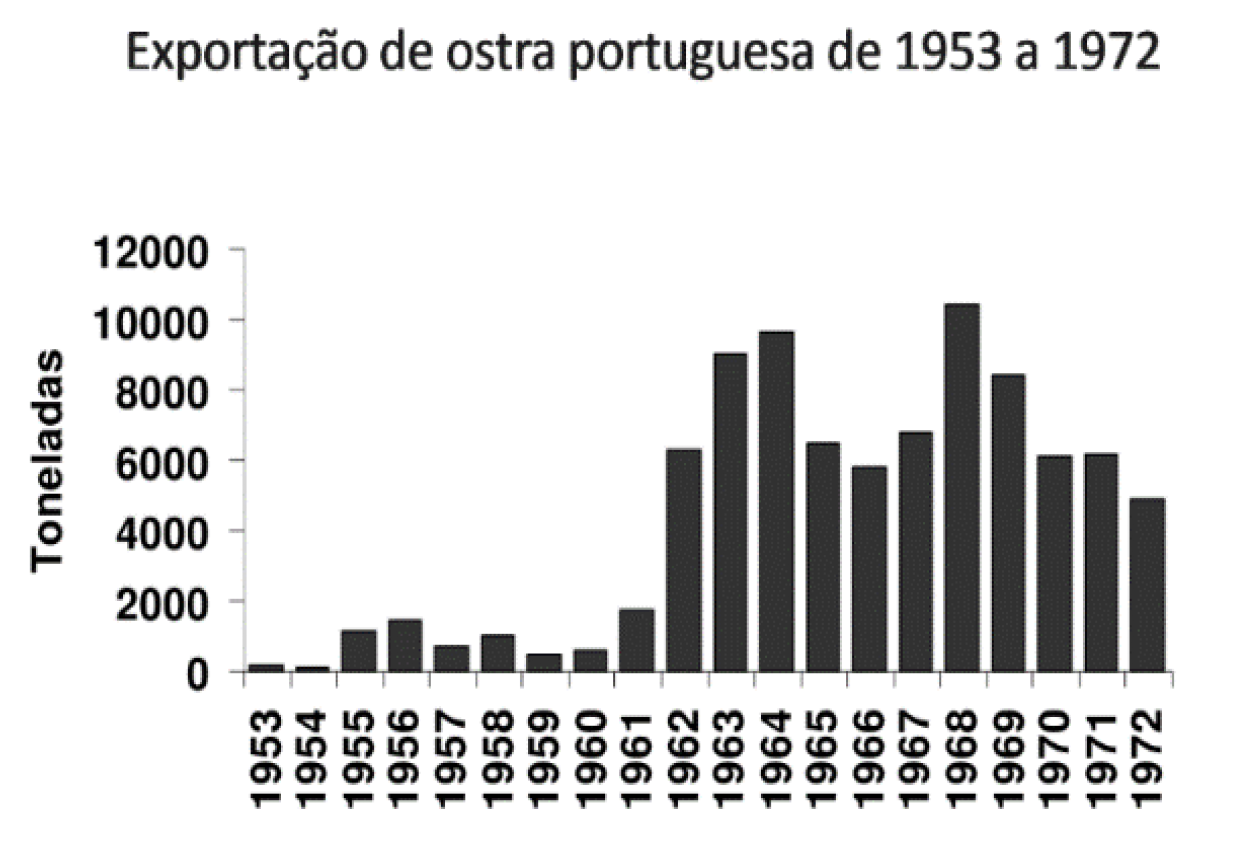
Entre 1953 e 1973, os estuários dos rios Tejo e Sado eram os maiores bancos naturais de toneladas de ostra-portuguesa, destinadas maioritariamente à exportação (Figura 10:
Exportação da ostra-portuguesa de 1953 a 1972 dos estuários do Tejo e Sado. ) para França, onde ganharam grande reputação, sendo ainda hoje recordadas pelos franceses como “Les portugaises” (Ver nota 33).
Repetidamente, em relatórios enviados ao Governo francês, é referido que a ostra-portuguesa oferece aos cultivadores “pelo menos o dobro das vantagens oferecidas pela ostra-francesa”. Além disso, foi o estuário do Tejo que permitiu a reabilitação das ostreiras de Arcachon e de Inglaterra. Estas ostras eram atacadas por várias patologias, que ameaçavam a sua destruição completa, e os cultivadores estrangeiros, principalmente os franceses, recorreram aos bancos naturais da ostra do Tejo e tornaram a povoar os seus parques ostreícolas [20]. Em 1954, cerca de 80% da área produtiva situava-se no estuário do Tejo, embora posteriormente o estuário do Sado tenha ganho cada vez mais relevância nessa produção [33].
No entanto, a partir de meados da década de 1960, a ostra-portuguesa começou a regredir por variadas razões. A poluição industrial, bem como a sobreexploração deste recurso, aliada à inexistência de uma gestão racional dos recursos vivos do estuário estiveram na origem da disseminação de doenças que quase extinguiram esta espécie [63].
60 Simon, C. (2006) “Spionid polychaetes infesting cultured abalone Haliotis midae in South Africa”, African Journal of Marine Science, vol. 28, pp. 167-171.
61 Sato-Okoshi, W. (2008) “Polydorid species (Polychaeta: Spionidae) in south-western Australian waters with special reference to Polydora uncinata and Boccardia knoxi”, Journal of the Marine Biological Association of the United Kingdom, vol. 88, pp. 491-501.
62 Bohens, G. (2012) “Parasitos e patologias de bivalves marinhos de importância econômica da costa brasileira”, Patologia e Sanidade de Organismos Aquáticos.
63 Fabioux, C. (2002) “Past and presente geographical distribution of populations of Portuguese (Crassostrea angulata) and Pacific (C. gigas) oysters along the European and north African Atlantic coasts”, Société Française de Malacologie, nº 31, pp. 33-34.
Figura 10: Exportação da ostra-portuguesa de 1953 a 1972 dos estuários do Tejo e Sado. [33]
De acordo com as pesquisas feitas, as concentrações muito elevadas de indivíduos no mesmo espaço induziram “stress”, o que facilitou o desenvolvimento e propagação de doenças. A instalação da indústria neste estuário, com a consequente poluição do meio aquático, veio acentuar a fragilização das defesas imunitárias da espécie, desequilibrando todo o ciclo de vida da ostra e originando a sua quase extinção [64].
Face ao desaparecimento da ostra-portuguesa nos estuários do Tejo e Sado, os produtores franceses, os maiores importadores deste molusco, para manterem a sua capacidade produtiva, passaram a importar a ostra do Japão, a espécie Crassostrea giga [65]. A maior resistência demonstrada por esta espécie, bem como o seu mais rápido crescimento fez com que os produtores se rendessem ao maior retorno financeiro. O desenvolvimento tecnológico alcançado, entretanto, permitiu a reprodução assistida de bivalves em cativeiro, o que teve como consequência uma produção massificada da ostra Crassostrea giga. A manipulação genética da ostra, através da criação de estirpes triploides estéreis, conseguiu taxas de crescimento mais rápidas. (ver nota 59)
64 Renault, T. (1966) “Appearance and spread of diseases among bivalve molluscs in the northern hemisphere in relation to international trade”, Revue Scientifique et Technique de l’Office International des Epizooties, vol. 15, nº 2, pp. 551-562
65 Grizel, H. (1991) “Introduction into France of the Japanese oyster (Crassostrea gigas)”, ICES Journal of Marine Science, vol. 47, nº 3, pp. 399-403.
As maternidades de bivalves estrangeiras produzem anualmente biliões de espécimes de ostra-japonesa que exportam para toda a Europa. A ostra “Giga” chegou assim a Portugal e invadiu a costa, onde se reproduziu e continua nos bancos naturais de ostras [60].
Desde 2008, a mortalidade crescente atingiu a ostra-japonesa em França, associada à detecção do herpesvírus das ostras (OsHV-1). A taxa de mortalidade das ostras juvenis teve no ano passado (2009) um valor médio próximo dos 80%, sendo nalgumas produções de 100% (perda total) [66]. Face a este fenómeno, que não está ainda devidamente explicado e compreendido, mas que se sabe ter origem na disseminação de diversos agentes patogénicos (vírus e bactérias), os produtores franceses começaram a procurar outros locais para manterem a sua produção. A produção massificada de ostras em França estará provavelmente na origem deste fenómeno, com características semelhantes ao que ocorreu nos anos 60 em Portugal [62], [67].
A solução encontrada pelos produtores passa por a produção da ostra “giga” ser feita noutros locais, nomeadamente nos estuários em Portugal. A manter-se esta tendência, os estuários dos rios nacionais e a nossa costa correm sérios riscos de ter uma “invasão” de ostra “giga” [59]. No entanto, isto pode implicar a transmissão do OsHV-1 para a ostra-portuguesa, uma vez que o vírus é transmissível através das águas e há uma elevada carga viral nas ostras moribundas (Figura 11: Transmissão de herpesvírus das ostras ].
O rio Mira e o rio Sado são os únicos locais em Portugal onde não existe ostra-japonesa e, de modo a evitar a propagação do vírus, é importante fazer prevenção: não introduzir, mesmo com certificado de sanidade, a ostra-japonesa; e não introduzir equipamentos ou materiais provenientes de zonas de produção contaminadas. Nos locais onde já existe a ostra-japonesa, como na ria Formosa e ria de Aveiro, é importante exigir certificados sanitários em que esteja claramente especificado que a ostra não tem vírus OsHV-1 (testes que podem ser feitos por PCR em tempo real) e limpar o equipamento e material constantemente. Outra medida de prevenção é a aquisição de semente de maternidade com maior resistência à mortalidade estival e ao vírus OsHV-1, especialmente triploides. A mortalidade pode variar entre 7 e 86%, dependendo da semente [68].

Figura 11: Transmissão de herpesvírus das ostras[64]
66 Martenot, C. (2011) “Detection of different variants of Ostreid Herpesvirus 1 in the Pacific oyster, Crassostrea gigas between 2008 and 2010”, Virus Research, vol. 160, nº 1-2, pp. 25-31.
67 Sauvage, C. (2009) “Ostreid herpes virus 1 infection in families of the Pacific oyster, Crassostrea gigas, during a summer mortality outbreak: Differences in viral DNA detection and quantification using real-time PCR”, Virus Research, vol. 142, nº 1-2, pp. 181-187.
Em termos globais, em 1975, a distribuição geográfica da ostra-portuguesa era descrita como tendo uma extensão desde a Grã-Bretanha até à costa de Marrocos, existindo também no Mar Mediterrâneo [33]. Mais recentemente, observou-se que a distribuição de ostra-portuguesa (C. angulata) é mais reduzida e, pontualmente, partilhada com a sua congénere ostra-japonesa (Crassostrea gigas) (Figura 12: Produção de ostra-portuguesa (Crassostrea angulata) e de ostra-japonesa (C. gigas) na Europa [66].
A distribuição das ostreiras depende de inúmeros factores, tais como: a forma e a intensidade com que a água circula no habitat, a salinidade, as particularidades do substrato onde se fixam as larvas, a temperatura do meio e a disponibilidade de alimento. Outros factores igualmente importantes para a distribuição são a rápida precipitação de materiais em suspensão (ex. vasa); a proliferação de doenças; a existência e a propagação de organismos comensais e competidores que podem evoluir para parasitas e/ou limitar o espaço e o alimento disponível; a pressão exercida pelos predadores naturais, como gastrópodes carnívoros, estrelas-do-mar, poliquetas, caranguejos, peixes e aves marinhas, sobre os indivíduos adultos, e as medusas sobre as formas larvares; a pressão exercida pelo Homem devido à grande procura no mercado; e a poluição. Estes factores individualmente e o seu efeito podem limitar a distribuição espacial e a abundância de indivíduos [66].
Figura 12: Produção de ostra-portuguesa (Crassostrea angulata) e de ostra-japonesa (C. gigas) na Europa[33]

68 Schikorski, D. (2011) “Experimental ostreid herpesvirus 1 infection of the Pacific oyster Crassostrea gigas: kinetics of virus DNA detection by q-PCR in seawater and in oyster samples”, Virus Research, vol. 1, nº 155, pp. 28-34.
65 Clegg, T. (2014) “Risk factors associated with increased mortality of farmed Pacific oysters in Ireland during 2011”, Prev Vet Med, vol. 113, nº 2, pp. 257-267.
66 Portela, T. (2016) “Distribuição e recrutamento da ostra-portuguesa, Crassostrea angulata (Lamarck, 1819), no estuário do Sado”, Departamento de Biologia Animal, Faculdade de Ciências da Universidade de Lisboa.
Historicamente, as ostreiras do estuário do Sado localizavam-se na Comporta, Carrasqueira, Ilha do Cavalo, Sachola, Longa, Monte da Pedra, Palma e Cachopos [67]. Os bancos naturais, que outrora ocupavam largos milhares de hectares, a partir da década de 1970 ficaram confinados à zona do canal de Alcácer, onde os escassos exemplares não garantiam uma exploração comercial [69]. A principal causa apontada para o declínio da actividade foi a poluição, nomeadamente das águas residuais industriais e urbanas, que eram encaminhadas para o estuário sem qualquer tratamento prévio. A sobreexploração, a gestão ineficaz ou inexistente dos bancos ostreícolas, a utilização de tintas com componentes organo-estânicos (estaleiros navais) e a manifestação de várias doenças também contribuíram para o desaparecimento das populações naturais [33].
Actualmente, na costa algarvia, ocorrem naturalmente as espécies ostra-plana (Ostra edulis), ostra-anã (Ostrea stentina) e ostra-portuguesa (Crassostrea angulata). A ostra-plana é nativa da Europa e ocorre naturalmente desde a Noruega até Marrocos e em toda a bacia mediterrânica. Tem sido uma espécie aproveitada para consumo humano desde há pelo menos 6.000 anos. A ostra-anã apresenta distribuição geográfica idêntica à ostra-plana, estendendo-se também pela costa atlântica do continente africano. Devido ao tamanho reduzido (cerca de 5 cm em idade adulta), esta ostra não tem sido alvo de apanha ou cultivo na Europa [31].
Em Portugal, a produção da aquicultura tem-se mantido relativamente constante ao longo do tempo. No período 2000-2009, produziu-se, em aquicultura, entre 6000 e 8000 t de produtos marinhos. Grande parte desta produção provém de pequenas unidades de produção, com destaque para o cultivo de bivalves, moluscos e peixes marinhos [24].
No passado, a ostra-portuguesa teve um maior significado económico na produção aquícola da ria Formosa [69]. Estas culturas eram realizadas com juvenis obtidos na natureza que eram depois colocados directamente nos sedimentos dos viveiros. No entanto, dada a sua quase extinção, a produção desta espécie diminuiu drasticamente. Actualmente, os aquicultores da ria Formosa produzem ostras C. gigas, provenientes de diferentes centros de reprodução franceses, em sacos de rede sobreelevados, em mesas ostreícolas [28].
Em Portugal, entre 2000 e 2009, a produção desta espécie foi em média de 426.9 t, sendo juntamente com C. angulata e O. edulis uma das espécies produzidas com maior taxa de exportação, na ordem das 250 t/ano [24].
67 Dias, M. D. “Contaminação bacteriana de moluscos bivalves”, em Seminário sobre Recursos Haliêuticos, Ambiente, Aquacultura e Qualidade do Pescado da península de Setúbal, Setúbal (26-27 Abril 1994), Publicações avulsas do IPIMAR, 1:195-205.
68 Ruano, F. “Contribuição para o apoio à moluscicultura no Estuário do Sado e Lagoa de Albufeira – Seminário sobre Recursos Haliêuticos, Ambiente, Aquacultura e Qualidade do Pescado da península de Setúbal, Setúbal, (26-27 Abril 1994)”, em Publicações avulsas do IPIMAR 1:195-205.
A ostra-portuguesa é um molusco bivalve filtrador com um ciclo de vida complexo. É uma espécie eurialina que sobrevive tanto em salinidades baixas (2 a 6), como em salinidades semelhantes às registadas em ambiente marinho, sendo geralmente encontrada em locais salobros e estuarinos [20]. De facto, o genoma da ostra-portuguesa dá-lhe capacidades para sobreviver a condições abióticas típicas dos estuários, como flutuações constantes de salinidade, presença de elevadas concentrações de metais ou condições extremas de dessecação [21]. A concha da ostra-portuguesa é também superior, quer como matéria fertilizante, em virtude da grande quantidade de fosfato de cal que contém, quer para a indústria cosmética, pela composição única em iões e outros componentes [70].
A maior ameaça à conservação da ostra-portuguesa é, sem dúvida, a poluição dos habitats naturais. O estuário do Sado é um bom exemplo onde as pressões humanas e os valores ecológicos colidem. Contudo, nos últimos anos, têm sido aplicadas várias medidas ambientais e planos de gestão a estuários nacionais pela Agência Portuguesa do Ambiente (APA) e pelo Instituto da Conservação da Natureza e Florestas (ICNF), com o intuito de proteger e recuperar habitats e populações de espécies protegidas ou ameaçadas, valorizar as suas particularidades ambientais, gerir os recursos e assegurar a sustentabilidade dos ecossistemas estuarinos [71].
A defesa sustentada da ostra-portuguesa e neste caso concreto da biodiversidade do estuário do Sado e do Tejo passa também, sem dúvida, pela sua exploração comercial, estimulando as empresas nacionais a produzirem a ostra-portuguesa, os chefes de cozinha a utilizarem preferencialmente a ostra-portuguesa e o consumidor final a exigir o produto. Neste contexto, a Reserva Natural do Estuário do Sado lançou, em Setúbal, no ano de 2010, o programa “A Ostra-Portuguesa – Recuperação de um Património”, com o objectivo de criar um efeito mobilizador em defesa da ostra-portuguesa, que congregue esforços entre as diversas entidades, servindo ao mesmo tempo para divulgar, formar e informar os diversos agentes envolvidos [72]. A concretização deste programa sobre a ostra-portuguesa em Setúbal poderá vir a ser um evento determinante na recuperação deste património natural, bem como um evento de referência para a gastronomia e para o turismo na região. Estas iniciativas relacionadas com a ostra-portuguesa têm em consideração os vectores da Conservação da Natureza e da Biodiversidade [73]:
Recuperação da espécie Crassostrea angulata;
Turismo: desenvolvimento do conhecimento e informação aos turistas através do produto ostras e subprodutos associados;
Cultura: desenvolvimento da consciência das tradições ligadas às ostras nas comunidades locais;
Ciência: investigação para criação da espécie em cativeiro;
Desenvolvimento sustentável: criação de novos postos de trabalho, fixação das populações e criação de riqueza associada a métodos de produção que assegurem sustentabilidade;
Gastronomia: através de workshops para aprendizagem de técnicas de cozinha, receitas e manuseamento de ostras. Associação das ostras com vinhos da região, nomeadamente com espumantes. Oferta da restauração de Setúbal do produto ostras, criação da imagem de Setúbal como “cidade das ostras”.
Actualmente, na zona do canal de Alcácer, regista-se uma recuperação dos bancos de ostra, bem como a expansão dos mesmos para montante. Simultaneamente, nos estudos desenvolvidos pelo projecto CrassoSado, também se observou a recuperação desta espécie [74].
O projecto CrassoSado foi lançado em 2014/2015, com o apoio da Navigator. Este projecto visa estudar as condições de desenvolvimento da ostra-portuguesa (Crassostrea angulata) no estuário do Sado [75].
Segundo os resultados da fase mais recente do estudo CrassoSado, concluída em Agosto passado, foi possível continuar o levantamento dos bancos de ostra no estuário do Sado com amostragens no esteiro da Marateca e na zona da Carrasqueira. Estas localizações apresentavam espécimes em bom estado, com indícios de recrutamento e crescimento recente, confirmando-se que os povoamentos de ostra-portuguesa neste sistema têm vindo a recuperar a sua área de distribuição inicial [76].
70 Jardim, J. (2009) “The history and global market of oral home-care products”, Brazilian Oral Research, nº 1, pp. 17-22.
71 Caeiro, S. (2005) “Assessing heavy metal contamination in Sado Estuary sediment: na índex analysis approach”, Ecological Indicators, vol. 5, pp. 151-169.
72 Público, “A Ostra-Portuguesa – Recuperação de um Património”, 2010. [Online]. Available: https://www.publico.pt/2010/09/29/ciencia/noticia/a-ostra-portuguesa–recuperacao-de-um-patrimonio-1458523. [Acedido em Novembro 2018].
73 Instituto da Conservação da Natureza e das Florestas, “Estratégia Nacional de Conservação da Natureza e da Biodiversidade 2030”, 2017.
Hoje, as ostras são consideradas um alimento de alta qualidade, com um preço elevado: sazonalidade, delicadeza da sua cultura, sabor, valor nutritivo. A sua ligação a um território tornam-na valiosa numa estratégia de valorização patrimonial. Assim como sucede com alguns alimentos, as ostras tendem a ser comercializadas e consumidas associadas à sua designação de origem – e.g. “ostras de Setúbal”. A maioria das suas variedades pode ser consumida e muitos tipos podem ser comidos crus ou na concha. Em geral, as ostras menores são mais bem servidas cruas, enquanto as variedades maiores, como a ostra-do-pacífico, são utilizadas em receitas. As ostras podem ser cozidas no vapor, assadas, grelhadas ou fritas [77].
Para comer as ostras vivas e ao natural, de modo a conservar a sua qualidade e o seu delicado gosto a marisco, o prato deve ser temperado com sumo de limão, pimenta e manteiga, com vinho branco e fresco para acompanhar [77].
Para cozinhar a vapor, o lado de fora das conchas deve ser bem lavado em água corrente fria. Se as conchas estiverem abertas ou rachadas, é sinal de que está morta ou estragada. Normalmente, cozinha-se a ostra com vinho para dar sabor e aroma. Depois de cozinhadas, as conchas normalmente abrem-se, sinal de que as ostras estão prontas. As que não abriram durante o processo de cozedura são descartadas, pois podem estar estragadas ou não cozinhadas [77].
Para guardar as ostras, a melhor maneira é colocá-las com a concha inferior para baixo, num balde, cobrindo-as com um pano molhado e pondo sobre o pano uma tampa, de modo a que, carregando sobre as ostras, a válvula superior não abra [77].
74 The Navigator Company, “Ostra do Sado em recuperação”, 2017.
75 “Ostras em expansão no estuário do Sado”, Jornal do Pinhal Novo [Online]. Available: https://www.ulisboa.pt/sites/ulisboa.pt/files/public/ostras.pdf. [Acedido em Novembro 2018].
76 Ambiente Magazine, “Ostra do Sado em recuperação, de acordo com um estudo cientifico”, 24 Novembro 2017. [Online]. Available: https://www.ambientemagazine.com/ostra-do-sado-em-recuperacao-de-acordo-com-estudo-cientifico/.
77 Brito, J. As Ostras na saúde e na cozinha, Lisboa, 1957.
O costume de comer ostras data de épocas muito antigas. Na Dinamarca e, mais tarde, noutros países da Europa, América do Sul e África, amontoados de conchas foram encontrados, o que levou à conclusão de que o Homem já as utilizava como alimento. São numerosos os testemunhos de que essa utilização se tem mantido através dos tempos. Com efeito, sabe-se que os chineses as cultivavam desde os tempos mais remotos e que os gregos e os romanos as tinham a um preço muito elevado [78].
Na Roma Imperial, eram consumidas principalmente pela aristocracia, incluindo os próprios imperadores. Era frequente iniciar banquetes por ostras e outros mariscos, que se comiam das mais variadas maneiras. Desde então, o seu consumo não só aumentou como também se generalizou. Por exemplo, em França, na época de Luís XIV, apresentar ostras à mesa era dar provas de civilização de cortesia, de delicadeza e bom gosto. A perpetuar o apreço pelas ostras nessa época, ficou um dos melhores quadros da pintura francesa “Le Déjeuner d’huîtres” (Figura 13: “Le Déjeuner d’huîtres” é uma pintura de 1735 de Jean-François de Troy. [77].
Em Inglaterra, o consumo deste marisco atingiu tal incremento que Sam Weller dizia que, em Londres, havia uma loja de venda de ostras por cada meia dúzia de habitações [79].
Nos dias de hoje, o seu consumo é enorme, repartindo-se os seus apreciadores por todas as classes, de muitos países. O seu valor alimentar tem sido salientado na literatura devido às suas propriedades nutritivas, afrodisíacas e terapêuticas [80].

Figura 13: “Le Déjeuner d’huîtres”é uma pintura de 1735 de Jean-François de Troy.
Para um melhor equilíbrio alimentar, a Organização Mundial de Saúde (OMS) recomenda o consumo regular de pescado pelo menos duas vezes por semana [81]. É considerado um alimento de fácil digestão e rico nutricionalmente, por ser fonte de proteínas de alto valor biológico, vitaminas A, D, E, e vitaminas do complexo B e minerais, como o iodo, selénio, fósforo, sódio, potássio, ferro e cálcio. A sua gordura é composta maioritariamente por ácidos gordos insaturados e possui uma baixa proporção de ácidos gordos saturados, por esse motivo é considerada de melhor qualidade que a da carne de origem animal [80].
Dados do Instituto Nacional de Estatística referem a ostra como o segundo molusco mais procurado dentro do grupo dos moluscos e crustáceos, apenas suplantada em vendas pela amêijoa, sendo uma iguaria muito apreciada. Enquanto animais filtradores, as ostras reflectem em sabor e qualidade as características do meio em que vivem, sendo a sua composição bioquímica influenciada por factores como a temperatura da água, a qualidade e quantidade de alimento e a fase do ciclo reprodutivo, entre outros. A parte edível da ostra corresponde a cerca de 10% do seu peso total e é uma fonte importante de vitaminas A e B12, proteína e sais minerais. As ostras oferecem grande riqueza nutricional, concentrada em pouco peso de carne: para além do elevado conteúdo proteico, são especialmente ricas em zinco, vitaminas do grupo
B, iodo, selénio, cálcio e ferro. Outros nutrientes presentes nas ostras são fósforo, magnésio, sódio, cobre, manganésio, potássio, vitaminas A, C, D, E e ácidos gordos do tipo ómega-3. Além do interesse alimentar gastronómico, as ostras são utilizadas pela indústria farmacêutica enquanto fonte de zinco e de cálcio (Tabela 3) (Agência Portuguesa do Ambiente, 2017) [82].
78 Borsay, P. (2011) Resorts and Ports: European Seaside Towns since 1700, Channel View Publications, 2011.
79 Allingham, P. “London Oyster Shops”, The Victorian Web, 2017. [Online]. Available: http://www.victorianweb.org/history/london/oysters.html. [Acedido em 11 2018].
80 Bandarra, N e Nunes, M.(2012) “Valor nutricional das espécies de pescado mais consumidas em Portugal”, Fileira do pescado.
81 Docapesca, “Nutrição” [Online]. Available: http://www.docapesca.pt/.
82 Agência Portuguesa do Ambiente, “Boas práticas no cultivo de ostras”, Cyanopica Unipessoal Lda., Faro, 2017.
Tabela 3: Valor nutricional da ostra. Adaptada de [82].

O Mesolítico é um período da história particularmente interessante porque, entre outras razões, reportam-se às últimas comunidades de caçadores-recolectores [84] [85].
Os concheiros do Mesolítico do vale do Sado constituem um lugar privilegiado para a caracterização dos últimos caçadores‑recolectores e para a identificação de diferentes modalidades culturais (Figura 14: Concheiros do Mesolítico do Vale do Sado (Cartografia Enrique Cerrillo). 1 – Arapouco; 2 – Cabeço do Rebolador; 3 – Barreirões; 4 – Poças de S. Bento; 5 – Fonte da Mina; 6 – Barrada das Vieiras; 7 – Cabeço das Amoreiras; 8 – Vale Romeiras; 9 – Cabeço do Pez; 10 – Várzea da Mó; 11 – Barrada do Grilo; 12 – Barranco da Moura. Retirado de . A localização destes concheiros é junto ao antigo limite interior dos respectivos estuários, permitindo assim a maximização da exploração de uma vasta gama de recursos: aquáticos e terrestres, animais e vegetais [83].
A cronologia dos episódios de formação/ocupação dos concheiros, por grupos de caçadores‑recolectores, ainda é hoje em dia um tema de debate. São questões particularmente complexas quando são estes sítios frequentados por comunidades exclusivamente mesolíticas, ao nível da cultura material e das práticas de subsistência. Em simultâneo, alguns problemas associados à utilização de conchas de moluscos e de restos humanos, como amostras para obtenção de datações absolutas, acrescentam outros obstáculos à percepção da cronologia destas ocupações [84].
A economia destes povoados assentou na exploração de recursos marino-estuarinos (pesca, marisco, vegetais e produção de sal), desempenhando os alimentos agro-pecuários um papel muito secundário (ovicaprinos, gado porcino e bovino). Estes grupos foram descendo o rio, acompanhando a própria migração das condições estuarinas. Os seus habitats, de estruturas perecíveis, planos e abertos, instalados sobre solos arenosos, dispersam-se por ambas as margens do Sado, de Alcácer do Sal até à Mitrena e Faralhão, passando por Abul e Marateca, na margem direita e, na margem esquerda, localizados na área de Carrasqueira-Comporta (Figura 15). Os arqueossítios da margem direita foram sumariamente reconhecidos por prospecção de superfície, enquanto os da margem esquerda foram objecto de escavações arqueológicas, permitindo identificar um padrão locativo padronizado, próprio de uma cultura específica neolítica, de cerâmicas lisas, dotada de economia piscatória e recolectora, designada por Neolítico da Comporta [86].
Figura 14:Concheiros do Mesolítico do Vale do Sado (Cartografia Enrique Cerrillo). 1 -Arapouco; 2 -Cabeço do Rebolador; 3 -Barreirões; 4 -Poças de S. Bento; 5 -Fonte da Mina; 6 -Barrada das Vieiras; 7 -Cabeço das Amoreiras; 8 -Vale Romeiras; 9 -Cabeço do Pez; 10 -Várzea da Mó; 11 -Barrada do Grilo; 12 -Barranco da Moura. Retirado de [84].
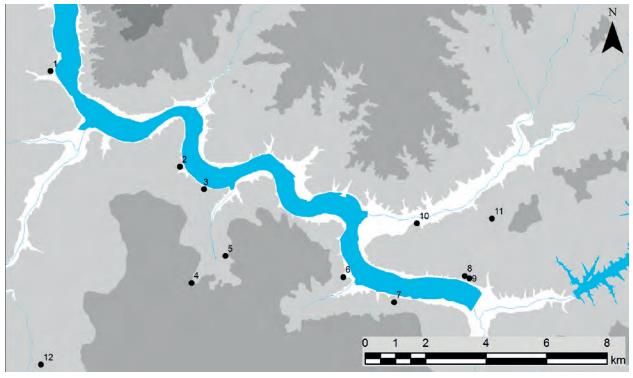
Figura 15: Sítios ribeirinhos do Neolítico do Baixo Sado: 1 –Território Neolítico da Comporta; 2 –Mitrena; 3 –Faralhão; 4 –Abul; 5 –Castelo de Alcácer do Sal
84 Cunha, E. (1995) “Abordagem antropológica das comunidades mesolíticas dos Concheiros do Sado”, O Arqueólogo Português, nº Série IV 13/15, pp. 161-179.
85 Cabal, P. “O Mesolítico e o Neolítico antigo: o caso dos concheiros do Sado”, em 5º Congresso do Neolítico Peninsular, Lisboa, Centro Arqueológico da Universidade de Lisboa, 2015.
86 Freitas, C.&A.C. (2008) “O estuário do Sado”, Embarcações Tradicionais. Contexto físico-cultural do estuário do Sado. Setúbal: Museu de Arqueologia e Etnografia do Distrito de Setúbal
Numa perspectiva mais aprofundada, pode afirmar-se que, logo a partir do IV milénio a.C., este grupo humano estabeleceu-se na região até então despovoada (Comporta I). A sua olaria conservava ainda aspectos estilísticos herdados do final do Mesolítico do Sado.
Esta população iria sofrer um apreciável aumento demográfico e, consequentemente, povoar uma vasta área na fase seguinte (Comporta II), ainda durante o IV milénio a.C. Os habitats Celeiro Velho, Malhada Alta, Barrosinha, Sapalinho e Possanco (Figura 16: Localização das jazidas neolíticas da Comporta na carta de esc. 1:50 000. 1 – Celeiro Velho; 2 – Possanco; 3 – Malhada Alta; 4 – Pontal; 5 – Barrosinha; 6 – Sapalinho; 7 – Carrasqueira. Adaptado de . ) estabeleceram-se em pequenos esporões arenosos, interflúvios de um complexo sistema de rias abrigadas do hidrodinamismo oceânico e favoráveis à exploração dos recursos marinhos. Durante esta fase, assistiu-se a uma progressiva sedimentação etno-sociológica e ao reforço da territorialização [84] [87].
Na Fase II do Neolítico da Comporta, a cerâmica acusa de forma nítida o carácter vincadamente regional da cultura que ali se desenvolve, muito diferente da do Neolítico agro-pastoril. A interacção entre estas duas realidades socioculturais tem por agora uma ténue evidência nas contas discóidais de xisto tão características do Megalitismo, encontradas na Barrosinha e em machados de anfibolito exumados no Possanco. Porém, é provável que a interacção se fizesse através de trocas regulares de bens alimentares: peixe salgado e/ou fumado, sal e moluscos disponibilizados pelas populações ribeirinhas e, em sentido inverso, pão e gado [84].
Durante a última parte do milénio IV e a primeira parte do III milénios a.C. (Comporta III), o sítio do Possanco é reocupado, após longo abandono. A estrutura económica mantém-se semelhante à da fase anterior, mas a cultura material adquire significativas inovações bem expressas na produção oleira (por exemplo, taças carenadas e decoração simbólica) e nos ideoartefactos. O Possanco, situado no mesmo ecossistema que os povoados anteriores, ocupou uma área parcialmente argilosa, das mais férteis daquela micro-região. A pesca e a recolecção, sobretudo da amêijoa, continuam a ser praticadas. A extracção de sal marinho por via ígnea é documentada por depósitos de material cerâmico grosso. Ao contrário dos povoados da Fase II, a última fase do Neolítico da Comporta apresenta indícios de uma maior abertura ao exterior, através de trocas regulares, por hipótese comandadas pelo sal, nesta fase mais necessário nos povoados do interior onde a população se adensava, e os excedentes também, exigindo conservação nos grandes povoados de silos e fossos [88].
Teríamos, assim, nas sociedades do sudoeste peninsular do Neolítico médio e final, dois modos de produção distintos, mas coetâneos: o modo de produção doméstico evolucionado ou megalítico e o agro-marítimo estuarino (até agora reconhecido nos estuários do Tejo, Sado, ribªs de Seixe e Quarteira, Guadalquivir), subordinado ao primeiro [86] [88].
87 Tavares da Silva, C. “As primeiras comunidades neolíticas”, em História de Portugal, Lisboa, Editora Alfa, 1983.
88 Soares, J. “Transformações sociais durante o III milénio AC no Sul de Portugal. O povoado do Porto das Carretas”, Dissertação de Doutoramento, Faculdade de Ciências Sociais e Humanas da Universidade Nova de Lisboa, Lisboa, 2011.
Figura 16: Localização das jazidas neolíticas da Comporta na carta de esc. 1:50 000. 1 –Celeiro Velho; 2 –Possanco; 3 –Malhada Alta; 4 –Pontal; 5 –Barrosinha; 6 –Sapalinho; 7 –Carrasqueira.Adaptado de [86].
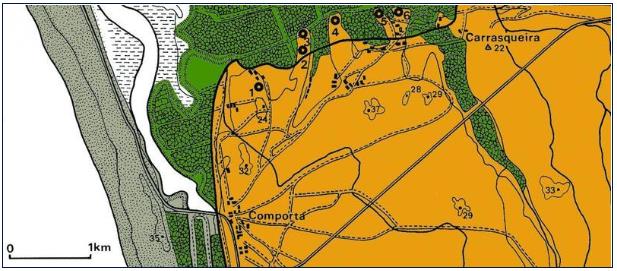
Devido às suas condições geográficas, Setúbal foi palco de ocupações urbanas desde muito cedo. O primeiro contacto das populações da região de Setúbal com o mundo romano ocorreu no século I antes de Cristo. O modo de vida das populações foi sendo influenciado pelos contactos com a cultura romana, sofrendo alterações significativas após o período da conquista, na fase da colonização (período Romano Imperial). Nessa altura, foram fundados dois centros urbanos: Caetobriga (Setúbal) e Salacia (Alcácer do Sal) [89].
O processo colonizador foi rápido e eficiente. Os vestígios arqueológicos dão-nos conta, a partir do século I, de uma sociedade urbana, esclavagista e militarizada. A região de Setúbal atravessou um período de grande florescimento económico entre o século I e os finais do séc. II, especializando-se no fabrico de salgas de peixe [89].
As fábricas de salga são zonas muradas, mais ou menos rectangulares, apresentando junto das paredes externas os tanques de salga (também chamados “salgadeiras” ou “cetárias”) de diversas dimensões e a meio encontrava-se o pátio (zona de circulação). As fábricas apresentavam telhado sobre os tanques que era suportado pelas paredes externas e por pilares junto do pátio, uma vez que a área central era a descoberto, para facilitar o arejamento e a entrada de luz para a laboração, protegendo ao mesmo tempo as produções das intempéries. O peixe, depois de descabeçado e destripado, era colocado em camadas alternadamente com sal até encher os tanques, ficando assim durante uns tempos, sendo posteriormente a salga de peixe embalada em ânforas (recipientes de barro), que de barco seguiam em direcção ao Mediterrâneo, a fim de serem exportadas para o Império [89] [90].
Além das salgas, nos tanques mais pequenos eram produzidos outros preparados de peixe, como molhos que serviam para condimentar os alimentos. Eram feitos a partir de uma pasta base, a salsamenta. O garum, um dos mais apreciados molhos, era feito com peixes pequenos (anchovas, cavalas, sardinhas), restos de peixes grandes (as cabeças e tripas que não eram utilizadas nas salgas), moluscos (amêijoa, berbigão, entre outros), caranguejos, tudo misturado com sal e fermentado durante cerca de três meses. Posteriormente, esta matéria fermentada era coada e o líquido mais ou menos espesso seria aproveitado. A este líquido, juntava-se ainda vinho velho, e estava pronto a ser utilizado [90].
A ostra era uma das iguarias mais exportadas. Nitidamente, estava ligada a aspectos culturais e era reconhecidamente apreciada no período romano. O prato típico dos romanos mais pobres era uma mistura ou papa de água, cevada, aveia ou trigo: chamada puls. A este prato podia juntar-se, tornando-a uma versão mais enriquecida, vinho e miolos de animais e ser acompanhada com azeitonas, feijão, figos, queijo ou mesmo porco. Existiam algumas outras variantes da puls: a puls fabata (feita com favas) e a puls punica (que continha queijo, mel e uma gema de ovo) ou a puls iuliana, que continha ostras fervidas e vinho [91].
O alimento-base no mundo romano é, assim, o cereal transformado em pão. Os próprios soldados eram, muitas vezes, recompensados em trigo. Os cereais, legumes, hortaliças, leite e ovos faziam também parte da dieta elementar, existindo em Apício inúmeras receitas com a sua utilização. Alimentavam os porcos com figos, para que a sua carne ficasse perfumada, e criavam os gansos de maneira especial, para com eles preparar patês. Um tratamento similar era feito com os frangos, que eram alimentados com anis e outras especiarias [92].
Sabe-se também que, até ao século II a.C., a base alimentar dos grupos sociais diferia pouco, e só após a Expansão do Império se verifica uma crescente diferenciação [93]. A imagem de luxúria alimentar é, portanto, muito exagerada e a maioria das pessoas normais tinha uma dieta vulgar, não podendo sequer provar as iguarias descritas literariamente. Por outro lado, no século IV, também há relatos de festas onde a ementa de um banquete oficial oferecido a pretores do tempo de César era de mariscos, ostras, mexilhão; tordo com espargos, galinha cozida, castanhas e molho de mexilhão e ostras. Estas iguarias eram consumidas como entradas e acompanhadas de vinho doce. Seguia-se o primeiro prato com outros mariscos, peixes, papa-figos, filetes de javali, pasta de carne de aves e de caça. O prato principal incluía úberes de porca, cabeça de porco, guisados de peixe, de pato, de lebre e aves assadas. Estas iguarias eram servidas simultaneamente a todos os convidados da festa em tabuleiros, e aqueles escolhiam a seu gosto [92].
A economia da zona de Setúbal, particularmente direccionada para a exportação, por via marítima (Roma incluída), mostrou-se muito sensível às flutuações económico-sociais do Império Romano. O colapso desta economia aconteceu nos finais do século IV/ inícios do século V depois de Cristo. As fábricas de preparados de pescado foram abandonadas e transformadas, umas em cemitérios, outras em lixeiras. Setúbal sofreu uma profunda desurbanização entre o séc. V e o séc. XIII [[92].
89 Fernandes, L. (2011) “A transformação de produtos piscícolas durante a Época Romana em Olisipo: o núcleo da Rua dos Bacalhoeiros (Lisboa)”, Revista Portuguesa de Arqueologia, vol. 14, pp. 239-261.
90 Bernardes, J. (2015) Consumo e transformação de peixe entre o mundo romano e o islâmico, Memória dos Sabores Mediterrânicos.
91 Veyne, P. (2009) O Império Romano, História da vida Privada I: do Império Romano ao ano 1000.
92 Barata, F. (2014) O Vinho e a Alimentação em Época Romana, Museu do Vinho de Alenquer.
93 Bustamante, R. (2005) Banquete romano, comensalidade em tempo de Paz, “Anais suplementares do XXIII Simpósio Nnacional de História”, Londrina, 17- 22/7/2005 – História: guerra e paz.
O acentuado declínio de Setúbal favoreceu o Castelo de Palmela (Figura 17: Castelo de Palmela, em Setúbal) a adquirir maior importância durante este período devido às suas condições geográficas. Foram os muçulmanos que começaram a edificar a sua fortificação entre o século VIII e IX, visto que oferecia grandes condições de defesa. Logo depois de Lisboa ser conquistada por D. Afonso Henriques deu-se a conquista de Almada e Sintra. A conquista de Palmela foi fácil, pois os muçulmanos simplesmente abandonaram a vila. As forças muçulmanas estavam a preparar-se em Alcácer do Sal e mais tarde recuperaram a margem sul do rio Tejo. O exército cristão reconquistou Palmela novamente em 1158 e finalmente em 24 de Junho de 1165, sendo feitas logo no ano seguinte obras de reforço à fortificação [94].
Após a reconquista cristã, com a pacificação da região, surgem condições favoráveis ao desenvolvimento da pequena povoação de Setúbal, cuja economia irá assentar na pesca e no comércio marítimo e, posteriormente, na exploração do sal. Setúbal encontra-se dependente administrativamente de Palmela. O desenvolvimento atingido pela burguesia setubalense vai determinar a abertura ao culto, em 1248, da primeira igreja de Setúbal (Igreja de Santa Maria da Graça) e a consequente criação de uma freguesia religiosa própria, ficando a população liberta da sujeição paroquial de Palmela. Além da libertação religiosa, a concessão do primeiro foral um ano depois, em 1249, vem conceder a Setúbal a autonomia político-administrativa, tornando-a totalmente independente [95].
O ressurgimento da vila de Setúbal está estreitamente associado à ascensão da burguesia. A construção de uma poderosa muralha no séc. XIV, custeada pela população, é bem a prova do crescimento económico da vila de Setúbal. Hoje podemos ainda observar diversos aspectos da muralha, como um dos arcos das portas que ainda conserva a sua traça original, a Porta do Sol, também conhecida como Porta da Moura Encantada (Figura 18: Porta do Sol, também conhecida como Porta da Moura Encantada.) (Liga dos Amigos de Setúbal e Azeitão, 1990) [96].
Na época dos Descobrimentos, Setúbal é uma vila de considerável importância, sobretudo devido à sua riqueza ligada à actividade comercial, principalmente no que diz respeito à produção do sal. Além do consumo local e regional, era produzido para exportação, sobretudo para o Norte da Europa. Restam em Setúbal alguns edifícios da época de estilo Manuelino que atestam o gosto arquitectónico, decorativo, do período em questão, como por exemplo a Igreja de São Julião (Figura 19: Igreja de São Julião.), algumas portas de casas com as suas cantarias trabalhadas, o Convento de Jesus [97].
No início do século XVIII, inicia-se um declínio económico. O comércio do sal perde a sua rentabilidade e muitas marinas entram em abandono, criando tensões sociais e a decadência da “aristocracia do sal”, o que já vinha acontecendo desde o domínio espanhol [96]. No entanto, muitos autores apontam uma prosperidade económica florescente para a vila sadina na primeira metade do século XVIII, baseando-se em testemunhos coevos, como o de Frei Luís de Sousa, que afirmava que Setúbal era “huma das melhores, e mais ricas Villas doReyno; que por isso goza o título de Notauel. E das que reconhecem ao Mestre de Santiago a melhor e mais importante” (ver nota 23)
O terramoto de 1755 veio como que fechar o ciclo do ocaso iniciado no início da centúria. O terramoto, acompanhado de tsunami e incêndios violentos, terá destruído grande parte da cidade. A verdadeira dimensão das perdas – humanas e materiais – será sempre uma incógnita, mas, atendendo ao impacto psicológico e aos relatos apaixonados dos sobreviventes, como o de Frei Francisco de Santo Alberto, terá sido bastante severa. As informações paroquiais de 1758 dão-nos conta de várias ruas inteiramente arruinadas, vários equipamentos públicos, bem como igrejas e conventos [98].
No final do séc. XVIII, período de florescimento do país devido à exploração do ouro e dos diamantes do Brasil, assiste-se a um amplo movimento de edificação e de reconstrução ao gosto do estilo Barroco. Muitos dos edifícios senhoriais ocuparam a área mais perto da antiga praia, que, por estar junto do rio, era bafejada pelo ar fresco, apetecível para a localização das novas casas da população endinheirada. A área urbana mais antiga do Centro Histórico era densamente ocupada. Sendo o Barroco mais do que um mero estilo arquitectónico, influenciando os mais diversos aspectos sociais, quer de filosofia de vida, quer decorativos, as suas marcas aparecem também na redecoração do interior das igrejas através da talha dourada e dos azulejos azuis e brancos. Também em azul e branco são os registos de azulejos que aparecem no exterior de alguns edifícios, com a figura de santos colocados após o terramoto de 1755, de forma a proteger as mesmas de futuras calamidades [99].
Nos finais do séc. XIX, o factor de crescimento de Setúbal está relacionado sobretudo com a indústria de conservas de peixe em azeite. Esta fase é patente na construção não só das fábricas ligadas a esta actividade, mas também na edificação dos bairros operários e do bairro residencial ligado aos proprietários de fábricas, o Bairro Salgado. (ver nota 97)
A comunidade sadina encontrava-se num ciclo de prosperidade que continuaria até meados do século XX. De uma forma ou de outra, podemos concluir que o rio Sado esteve sempre presente na responsabilidade do desenvolvimento de Setúbal [100].
94 Mendes, F. “A Criação da Rede Paroquial na Península de Setúbal (1147-1385)”, Dissertação de mestrado em História Medieval apresentada à Faculdade de Letras da Universidade de Lisboa, Lisboa, 2010.
95 Oliveira, J. “Na Península de Setúbal, em finais da Idade Média: organização do espaço, aproveitamento dos recursos e exercício do poder”, Dissertação de Doutoramento em História Medieval, apresentada à Faculdade de Ciências Sociais e Humanas da Universidade Nova de Lisboa, Lisboa, 2008.
96 Liga dos Amigos de Setúbal e Azeitão, “Setúbal na História”, Edições Lasa, 1990.
97 Almeida, M. “Convento de Jesus (Setúbal), Arqueologia e História: Faiança decorada”, Dissertação apresentada para cumprimento dos requisitos necessários à obtenção do grau de mestre em Arqueologia, Lisboa, 2012.
98 Coelho, R. “A intervenção arqueológica no Largo António Joaquim Correia, Contributo para o estudo da vida quotidiana em Setúbal no tempo do grande terramoto”, Dissertação de Mestrado em História e Arqueologia dos Descobrimentos e da Expansão Portuguesa apresentado à Faculdade de Ciências Sociais e Humanas da Universidade Nova de Lisboa, Lisboa, 2009.


Figura 18: Porta do Sol, também conhecida como Porta da Moura Encantada.
Figura 19: Igreja de São Julião.

Figura 17: Castelo de Palmela, em Setúbal
Desde tempos pré-históricos que o rio Sado foi um importante factor para o desenvolvimento da região setubalense. Devido à sua boa navegabilidade e a uma baía natural abrangida, potenciou a exploração dos seus recursos marinhos e também serviu como importante via mercantil e de comunicação. O rio motiva a existência de estaleiros importantes, não só no que respeita às embarcações de pesca, mas também caravelas usadas para os Descobrimentos (algumas das primeiras viagens terão sido realizadas a partir do Sado) [101].
O porto de Setúbal detém excelentes condições naturais e está estrategicamente situado, com boas ligações terrestres quer em termos de acessibilidades rodoviárias, ferroviárias, sendo estas directas e descongestionadas devido ao afastamento da actividade portuária em relação ao centro urbano. O acesso é feito sobre um canal, denominado canal da Barra, e que tem a profundidade de 12m, apresentando uma extensão de 5Km e 200m de largura. Dispõe de infra-estruturas para a movimentação de todos os tipos de carga, como carga contentorizada, fraccionada e granéis, sólidos e líquidos. As principais mercadorias transaccionadas são: automóveis, fuel, óleo, produtos metalúrgicos, florestais, cimento, cereais, frutas e outros produtos alimentares. O rio Sado é assim um grande catalisador de experiências de grande valor económico, social e cultural [102].
O rio Sado nasce a cerca de 230 m de altitude, na serra da Vigia, a sudoeste de Ourique, tem uma extensão de aproximadamente 180 km e desagua no oceano Atlântico através de um canal estreito e profundo entre a península de Tróia e a serra da Arrábida. A sua bacia hidrográfica drena uma área de 7 692 km2, abrangendo parte dos distritos de Beja, Évora e Setúbal [103].
A pesca sempre foi uma actividade muito importante para a subsistência das populações. O rio Sado não só fornecia abundância de peixe, como o sargo, o robalo e a pescada, como também servia para chegar ao mar alto, onde se capturavam outras espécies de grande importância económica. Durante a fase de industrialização setubalense, nos finais do séx. XIX/ inícios do séc XX, a apanha da sardinha e do carapau para a indústria de conservas de peixe e azeite era de grande importância, não só para a exportação, como também porque permitia a criação de vários postos de trabalho. É no estuário do Sado que se concentra a maioria da população de ostra-portuguesa [66].
99 Afonso, P. “O retábulo em Setúbal”, Dissertação para obtenção do Grau de Mestre em História da Arte –especialização em História da Arte Portuguesa, Faro, 2009.
100 Municipio de Setúbal, Setembro 2018. [Online]. Available: https://www.mun-setubal.pt/festival-poe-ostra-a-prova/. [Acedido em Dezembro 2018].
101 Gomes, S. “Territórios medievais do pescado do Reino de Portugal”, Tese de Mestrado em Alimentação – Fontes, Cultura e Sociedade, apresentada à Faculdade de Letras da Universidade de Coimbra, Coimbra, 2011.
O estuário do Sado, alongado e com uma orientação SE-NO, ocupa uma área de cerca 160 km2, desde Alcácer do Sal até ao oceano Atlântico. A zona central, denominada Baía Central, está parcialmente dividida em dois canais: o Canal Norte, onde predomina uma corrente superficial enchente que pode variar consoante a maré, e o Canal Sul, onde predomina uma corrente vazante mais forte; estes dois canais estão separados entre si por bancos de areia [103] [104]. A Baía Central tem cerca de 20 km de comprimento, 5 km de largura e profundidade média de 20m, apresentando características eualinas. Apresenta ainda dois esteiros, o da Marateca e o da Comporta, com direcção norte e sul, respectivamente. Estes exibem características eualinas ou polialinas em situações de maior carga pluvial [105] [106].
O estuário do Sado é o segundo maior estuário português e uma das zonas húmidas mais importantes da Europa [105]. Apresenta grande diversidade de habitats, como, por exemplo, zonas de macrófitas marinhas, zonas de ostreiras ou zonas com plataformas intertidais de vasa. É um estuário que apresenta uma produção primária baixa a moderada. As concentrações de clorofila podem variar entre 2 e 3 mg/m3 na zona mais próxima da foz (estuário inferior), entre 5 e 10 mg/m3 no esteiro da Marateca e entre 20 e 40 mg/m3 no canal de Alcácer [104].
A distribuição do fitoplâncton no estuário do Sado tem grande influência marinha [106]. Na zona mais próxima da foz, predominam espécies marinhas, sobretudo Bacillariophyceae do grupo Centrales, associadas a fenómenos de afloramento costeiro. Na zona média do estuário, existem tanto espécies marinhas, como espécies estuarinas, destacando-se as Bacillariophyceae, do grupo Penales. Na zona superior, no canal de Alcácer, em conjunto com as espécies de diatomáceas marinhas, aparecem espécies de fitoflagelados e espécies do grupo Dinophyceae. A densidade do fitoplâncton aumenta de jusante para montante, variando entre poucos milhares a centenas de milhares de células por litro [104] [106].
A comunidade de zooplâncton existente no estuário não é conhecida com detalhe na sua totalidade; no entanto, acredita-se que copépodes e rotíferos serão as fracções mais abundantes no estuário [107]. Para além destas observações, é comum, tal como nos restantes estuários portugueses, o domínio de grupos como Copepoda, Cladocera, e uma proporção importante de organismos meroplanctónicos, tais como as larvas de diversos Mollusca, Cirripedia, Decapoda, Polychaeta, hidrozoários, entre outros [108] [109]. As larvas de peixes constituem também uma parcela considerável no zooplâncton estuarino [109]. No estuário do Sado, a comunidade de invertebrados é representada por, pelo menos, 592 espécies, das quais se destacam 228 de poliquetas, 193 de crustáceos, 81 de bivalves e, pelo menos, 4 de cefalópodes [66].
Devido à localização geográfica do estuário (Figura 20: Localização geográfica do estuário do Sado em Portugal. ), as espécies ictíicas apresentam afinidades com o Atlântico Norte e o Mediterrâneo. A comunidade ictíica do estuário é constituída por 111 espécies, que se dividem pelos seguintes grupos fenológicos: residentes, ocasionais dulçaquícolas, ocasionais marinhas, marinhas que utilizam o estuário como área de viveiro, migradoras catádromas e migradoras anádromas. As famílias com maior representatividade de espécies são: Sparidae, Soleidae, Labridae e Gobiidae [110]. A montante, apesar de existir menor diversidade de espécies, estas apresentam maiores abundâncias; a jusante, observa-se maior riqueza específica devido à proximidade com o oceano. O estuário é também um importante local de residência, de passagem ou de invernada para um grande número de espécies de aves aquáticas. No que diz respeito a mamíferos marinhos, há registos da presença de lontas (Lutra lutra) na zona superior do estuário e uma população residente de cerca de 27 indivíduos de golfinhos-roazes (Tursiops truncatus) [111].
As pressões sobre o estuário do Sado são diversas, algumas contíguas ao sistema, outras ao longo da respectiva bacia hidrográfica afluente. As maiores pressões urbanas e industriais concentram-se na margem norte, perto da cidade de Setúbal; mais dispersas estão algumas zonas dedicadas à agricultura e à aquicultura. Na margem sul, destacam-se os empreendimentos turísticos de Tróia, que representam pressões apenas sazonais [107].
Relativamente à bacia hidrográfica do rio Sado, as actividades que predominam são a agricultura, a pecuária, a manutenção e exploração de terrenos florestais e a extracção mineira (lixiviação de gangas expostas) [103]. Setúbal possui 12 Estações de Tratamento de Águas Residuais (ETAR), 7 das quais drenam a água tratada para o rio Sado ou para linhas de água tributárias. Aliada a esta rede, existe ainda outra ETAR num dos parques industriais do município. A mais antiga data de 1985 (Aldeia Grande) e a mais recente data de 2008 (Gâmbia). A ETAR que trata as águas residuais da zona urbana foi construída em 2002 [112].
O estuário do Sado adquiriu ao longo do tempo vários estatutos de protecção, para que haja um equilíbrio entre a exploração de recursos e a sua integridade natural. Os que mais se destacam são a Reserva Natural do Estuário do Sado (DL nº 430/80, de 1 de Outubro) e a Zona Especial de Conservação – Sítio PTCON0011 Estuário do Sado (pela Directiva Habitats 92/43/CEE transposta para o direito nacional pela Resolução de Conselho de Ministros nº 142/97, de 28 de Agosto), estando igualmente inserido na rede de sítios Ramsar, desde 1996. Em águas costeiras, perto da foz, situa-se o Parque Marinho Professor Luiz Saldanha (Decreto Regulamentar nº 23/1998 de 14 de Outubro, com as alterações introduzidas pelo Decreto Regulamentar nº 11/2003 de 8 de Maio – reclassificação do Parque Natural da Arrábida e criação do Parque Marinho Professor Luiz Saldanha) [113].
102 Quintas, M. (2003) Porto de Setúbal – Um actor de desenvolvimento, História de um passado com futuro, APSS, SA, 2003.
103 Freitas, M. “Anthropogenic influence in the Sado estuary (Portugal): A geochemical approach”, Journal of Iberian Geology, vol. 34, nº 2, 2008.
104 Coutinho, M. (1994) Comunidade fitoplanctónica do estuário do Sado – Estrutura, Dinâmica e Aspectos Ecológicos, Provas de acesso à categoria de Investigador Auxiliar. IPIMAR.
105 Ferreira, R. “Caracterização Geoambiental do sítio da Carrasqueira (Estuário do Sado)”, Dissertação de Mestrado, FCUL, Lisboa, 2007.
106 Coutinho, M. (2003) Comunidade fitoplanctónica do estuário do Sado – Estrutura, Dinâmica e Aspectos Ecológicos, Provas de acesso à categoria de Investigador Auxiliar. IPIMAR.
107 Coutinho, M. (2003)“Comunidade fitoplanctónica do estuário do Sado – Estrutura, dinâmina e aspectos ecológicos”, Insituto Nacional de Investigação Agrária e das Pescas – IPIMAR.
108 Gonçalves, A. (2010) “Distribution and composition of small-size zooplankton fraction in a temperate shallow estuary (western Portugal)”, Fresenius Environmental Bulletin, vol. 19, nº 12b, pp. 3160-3176.
109 Muha, T. (2012) “The effect of distinct hydrologic conditions on the zooplankton community in a estuary under Mediterranean climate influence”, Ecohydrology & Hydrobiology, vol. 12, nº 4, pp. 327-335.
110 Gonçalves, J. “Use of temperate reef fish community to identify priorities in the estabilishment of a marine protected area”, Australian Society for Fish Biology, 2002.
111 Ferreira, M. “Movimentos e actividades dos golfinhos-roazes (Tursiops truncatus) na zona terminal do estuário do Sado e possíveis influências ecológicas”, Tese de mestrado. Biologia (Ecologia marinha) Universidade de Lisboa, Faculdade de Ciências, Lisboa, 2010.
112 Bicha, J. “Avaliação da Qualidade da Água do Rio Sado na Zona de Alcácer do Sal”, Dissertação apresentada na Faculdade de Ciências e Tecnologia da Universidade Nova de Lisboa para obtenção do grau de Mestre em Engenharia do Ambiente, Lisboa, 2008.
Figura 20: Localização geográfica do estuário do Sado em Portugal.
A situação geográfica de Setúbal, com o rio Sado a seu lado, fez com que desde muito cedo a sua população centrasse a sua actividade principal na exploração dos recursos marinhos. A pesca foi sempre uma actividade de grande relevo ao longo dos séculos, pelo que os bairros de pescadores foram-se formando fora do burgo medieval [114].
Para leste da muralha medieval e posteriormente fora da segunda linha de muralhas do séc. XVII, ao longo da praia, estabeleceu-se um grupo de pescadores pertencente à freguesia de São Sebastião e Palhais/Fontainhas. A ermida de S. Sebastião era a sede paroquial e localizava-se no Largo dos Defensores da República, junto do actual Miradouro; o sismo de 1755 deixou-a muito destruída, pelo que em meados do séc. XIX foi demolida. A paróquia transferiu-se para a igreja do Convento de São Domingos, construída na segunda metade do séc. XVI. Igreja frequentada pelos pescadores das Fontainhas, de uma só nave, com janelas de sacada, foi redecorada no séc. XVIII, apresentando azulejaria azul e branca e pinturas características dessa época, bem como a talha dourada [99].
O maior crescimento das Fontainhas ocorreu nos sécs. XVIII e XIX e está relacionado com a chegada de populações da Beira Litoral (Aveiro, Ovar, Murtosa), que trouxeram com elas as embarcações de fundo chato (saveiros, meias luas) e as artes de pesca bem adaptadas à pesca de rio [114].
O Bairro dos Pescadores ficava comprimido entre a praia e a segunda linha de muralhas. Já no período de industrialização da cidade de Setúbal, nos finais do séc. XIX, as fábricas de conserva de peixe invadiram o bairro. A ligação estreita entre o bairro e rio vai-se perdendo sobretudo a partir da construção da linha do caminho-de-ferro, que origina a divisão entre o local de trabalho (praia/rio) e o local de residência (bairro) [96] [114].
Os pescadores de Troino, cuja origem se situava em Setúbal e no Algarve, durante a “Setúbal industrial” dedicavam-se à pesca por conta de outrem, o armador, que possuía as embarcações e as artes de pesca. Cerca de 30 a 40 homens iam para o mar alto pescar o peixe mais barato para a indústria conserveira, ou seja, o carapau e a sardinha. O conjunto de cerca de três embarcações, constituídas por um barco principal, o galeão e por outros auxiliares (os buques), que transportavam as redes, mantimentos, entre outros, eram robustas, apresentando quilha, bem adaptadas a este tipo de pesca [114].
Depois da faina, o lucro obtido pela venda do pescado era distribuído de forma desigual, o grosso pertencia ao armador, enquanto aos pescadores cabia uma pequena parte do dinheiro. Por isso, estes pescadores de Troino viviam em piores condições do que os pescadores das Fontainhas, que dominavam as artes de pesca e pescavam com as suas pequenas embarcações, manobradas muitas vezes por duas pessoas (o pescador e um filho ou a mulher), o peixe fino, de rio, mais caro, sendo o lucro obtido pela venda do peixe na sua totalidade para o pescador e sua família [115]. Há actualmente no bairro de Troino restaurantes propriedade dos pescadores onde parte do pescado é vendido directamente no restaurante.
A indústria conserveira presente nos dois bairros vem transformar a azáfama da cidade, contribuindo para o seu cunho industrial, situando-se sobretudo ao longo da beira-mar. A sua produção destinava-se em grande parte para exportação para países como França e Inglaterra. O aparecimento desta indústria vem desenvolver antigas actividades, como a pesca, e novas, como a litografia e latoaria, entre outras. Nelas existiam três classes de trabalhadores: os homens, soldadores, cujo trabalho mais especializado permitia que recebessem o salário mais elevado, uma vez que recebiam pelo número de latas soldadas; as mulheres, que procediam sobretudo ao enlatamento do peixe e, por último, os moços, que não eram mais do que crianças que tinham sobretudo como função prestar auxílio como “moços de recados”, pelo que, sendo o trabalho menos especializado, recebiam o menor salário [115].
As novas tendências do sector evidenciam a redução das oportunidades da pesca e, consequentemente, das capturas. Deste modo, os governantes e os profissionais do sector discutem a necessidade de uma gestão dos recursos e do meio marinho mais eficaz, equilibrada e sustentada. Hoje em dia, estamos perante enormes desafios: garantir a sustentabilidade dos recursos, fomentar a competitividade do sector e assegurar a sustentabilidade económica e social das comunidades piscatórias. São estes os desafios que a classe política tem para o sector da pesca nos próximos anos [115].
Ainda assim, as ostras, na gastronomia, pertencem a uma categoria de comida rara e luxuosa. O perfil do consumidor é essencialmente uma pessoa de meia-idade, com rendimento mensal acima da média e com família. Do outro lado, os consumidores de comida mais jovens consideram as ostras um produto demasiado caro e difícil de abrir e as próprias características da ostra (viva, crua e viscosa) provocam repulsa ao produto. A diferença neste comportamento entre jovens e seniores pode provocar um baixo consumo de ostras no mercado muito em breve e levantar algumas questões como: como é que o consumo de ostras pode sobreviver através de gerações? Além disso, a ostra é um produto sazonal, nem sempre está disponível no mercado, mas no Natal e no Ano Novo atinge recordes de vendas. Mais divulgação sobre a confecção de ostras e diversificar os pratos que podem ser preparados com este produto podem ajudar a promover o produto entre os mais jovens [116].
Hoje, qualquer restaurante que ofereça um buffet variado traz opções com pescados crus, mais apetecíveis a jovens. A comida japonesa, em pouco tempo, tornou-se quase que uma febre nacional. Sushi, sashimi e temaqui são os mais populares [116].
O sushi surgiu no Sudeste asiático, provavelmente na China, mas foi no Japão que ficou mais conhecido. O sushi nasceu da necessidade de conservação do peixe cru. Por volta do século III d.C. os filetes de peixe eram salgados e arrumados em barris de madeira entre camadas de arroz. A libertação do ácido láctico azedava o peixe e garantia a sua conservação. Porém, o arroz ficava impróprio para o consumo [117].
No século VII, quando esta técnica foi introduzida no Japão, foi alterada e o sushi passou a ser guardado sobre pedras. No século XV, um novo tipo de sushi foi criado, com um período de fermentação menor (cerca de 1 mês). Isto ajudou a que o peixe e o arroz fossem consumidos juntos [118].
No século XVII, em Edo (Tóquio), introduziram o vinagre no preparo do arroz, o que possibilitou a redução ainda maior do tempo de preparo para mais ou menos 1 dia. Com a adição do vinagre, o peixe passou a ser consumido cru e fresco e também deu um sabor especial ao prato [118].
Foram inventando outras variedades e outras técnicas, até que no século XVIII surgiu o primeiro sushiman da história: Hanaya Ykei. Ele criou o tipo de sushi mais popular: um bolinho de arroz com uma fatia de peixe cru, cujo consumo podia ser imediato. Como ainda não existiam frigoríficos, os peixes eram marinados em molho de soja ou vinagre. A prensagem passou a ser feita pela força das mãos [118].
Em Tóquio, espalharam-se os quiosques de sushi tipo “fast–food”. Em 1923, quando a cidade foi atingida por um terramoto, muitos vendedores correram para outras regiões e assim se disseminou o sushi. Agora, desde o século XX, a globalização fez com que esta delícia japonesa se espalhasse pelo mundo inteiro e alcançasse um grande sucesso, também pela sua fama de ser um alimento saudável [117].
O ceviche é outro alimento tão popular como o sushi. Ceviche é um prato de peixe, geralmente branco, cortado em pequenas tiras e marinado durante várias horas em sumo de limão, muitas vezes com variadas pimentas. No final, são adicionadas finas meias rodelas de cebola roxa e coentros. Teve origem no Peru, mas é um prato constante em toda a América Latina, particularmente a do lado do Pacífico, do México até ao Chile. A versão clássica é ainda acompanhada de milho cozido e batata-doce cozida. O ceviche foi adoptado pelas cozinhas modernas e grandes chefes utilizam esta técnica, à qual juntaram outros alimentos, nunca alterando o essencial: a transformação que um líquido ácido opera em alimentos [119].
113 Ferreira, L. “Estudo da Evolução do Edificado no Parque Natural da Arrábida utilizando Sistemas de Informação Geográfica”, Dissertação para obtenção do Grau de Mestre em Engenharia do Ambiente, Lisboa, 2014.
114 Pereira, J. “A produção social da solidariedade operária – o caso de estudo da penísula de Setúbal (1890 – 1910)”, Dissertação apresentada para cumprimento dos requisitos necessários à obtenção do grau de Doutor em História Contemporânea, Lisboa, 2013.
115 Amorim, V. “Marés de incerteza – Etnografia do presente liminar na comunidade piscatória de Setúbal”, Dissertação submetida como requisito parcial para obtenção do grau de Mestre em Antropologia, Lisboa, 2015.
116 Debucquet, G. (2012) “Perception of oyster-based products by French consumers. The effect of processing and role of social representations”, Appetite, nº 59, pp. 844-852.
117 Patrocínio, I. “A segurança alimentar no consumo de pescado cru com valência para a produção de sushi”, Dissertação apresentada para a obtenção do Grau de Mestre em Tecnologia e Segurança Alimentar, pela Universidade Nova de Lisboa, Faculdade de Ciências e Tecnologia, Lisboa, 2009.
118 Feng, C. (2012) “The Tale of Sushi: History and Regulations”, Comprehensive Reviews in Food Science and Food Safety, vol. 11.
119 Gomes, V. “Ceviche”, 2018. [Online]. Available: http://virgiliogomes.com/index.php/cronicas/574-ceviche. [Acedido em Dezembro 2018].
A pescada sempre teve um peso enorme na alimentação humana. Com este capítulo pretende-se compreender como a ostra influenciou o rumo de desenvolvimento da região de Setúbal e como a pesca se tornou numa das principais actividades para os seus habitantes. Devido à sua localização geográfica privilegiada para as actividades piscatórias, pela extensa frente ribeirinha, uma zona ampla de estuário e um fácil acesso ao mar pelas embarcações, Setúbal dispõe de muitas variedades de peixe [96].
Os fenícios e os romanos utilizaram as costas da Península Ibérica como entreposto de conserva de pescado, de onde expediam peixe salgado para abastecimento das populações da Europa. Os tanques das Ruínas de Tróia e Setúbal testemunham a ancestralidade da tradição não só do consumo de peixe nesta região, como sobretudo da percepção do seu valor como bem económico. As sopas de peixe, as caldeiradas, tomatada de cavalas, choco frito, mexilhões, ostras, entre outras iguarias, compõem uma gastronomia rica, cheia de aromas e sabores, que fazem parte da dieta dos setubalenses nos dias de hoje e são prova viva de uma identidade alimentar continuada num território, valorizadora dos recursos do mar e da sua conjugação com os produtos da horta – (Liga dos Amigos de Setúbal e Azeitão, 1990). [96].
As populações de ostra-portuguesa ao longo da costa estão em expansão, principalmente no estuário do Sado, conclui um estudo científico promovido pelo Instituto da Conservação da Natureza e das Florestas (INCF) e patrocinado pela The Navigator Company [75].
Foi precisamente com o objectivo de caracterizar o estado atual da ostra-portuguesa no estuário do Sado e identificar as principais ameaças e oportunidades para a sua exploração que foi lançado em 2014/2015, com o apoio da Navigator, um projecto plurianual de investigação científica denominado CrassoSado, já mencionado anteriormente [74].
O Festival da Ostra de Setúbal, um evento anual, conta com a participação dos restaurantes da zona e com várias actividades culturais alusivas à apanha da ostra. Aulas de culinária e actividades de degustação também são promovidas por este festival [100]. O Festival do ano 2017 foi complementado pela exposição “Ostras do Sado”, com imagens antigas do Arquivo Fotográfico Américo Ribeiro relativas à actividade ostreícola (Figura 21) e exemplares de ostras e fósseis do sapal do Sado e da Arrábida, estas propriedade de Célia Rodrigues [120].
É a pesca, tal como já foi referida, a principal actividade económica da região. As outras actividades, como os serviços e o turismo, começaram a desenvolver-se recentemente. A agricultura e a exploração da madeira são profissões antigas que com o tempo têm sido esquecidas e abandonadas por falta de interesse ou por já não serem tão lucrativas. Neste distrito, também se pratica aquicultura, ou seja, a criação e reprodução de espécies aquáticas em ambientes controlados por humanos, como aquários e habitats artificiais. Existe até um festival dedicado à pesca em Setúbal, que ocorre no mês de Julho, a que é dado o nome “Viva o Peixe”, em que os pescadores de Setúbal oferecem o seu melhor peixe para depois ser cozinhado por chefes de cozinha de renome [121].
A agricultura é o sector com menos importância pelo facto de a população se dedicar mais à pesca. A vinicultura é o único tipo de agricultura rentável a ser praticado actualmente em Setúbal (São Lourenço – Azeitão). O vinho cultivado em Setúbal é vinho maduro, tinto e branco, e o vinho moscatel. Um exemplo de um vinho originário de Setúbal é o Moscatel de Setúbal. A Rota de Vinhos da Península de Setúbal / Costa Azul existe para surpreender quem visita uma região bafejada pela sorte, que reúne nos concelhos de Palmela, Setúbal, Montijo e Alcácer do Sal dez adegas, nas quais é possível saborear os vários tipos de vinhos do distrito [122].
A madeira, antigamente, era um recurso muito utilizado em Setúbal. Como Setúbal é abundante em sobreiros, a extracção e transformação de cortiça era uma actividade muito procurada por empresas, que construíram fábricas e armazéns em Almada, Barreiro, Montijo e Seixal. Com o passar do tempo, a cortiça foi desvalorizada, as empresas faliram e o sector da madeira foi diminuindo [96].
O turismo é um sector que surgiu há pouco tempo em Setúbal, mas é o que mais se tem desenvolvido. Este distrito tem mais de 50 praias, restaurantes, vários hotéis, alguns perto do mar ou no interior, casas térreas, azul e brancas, tipicamente alentejanas, e muitos vestígios arqueológicos e monumentos: do período pré-histórico, mundo romano, mosteiros, castelos do tempo medieval, conventos, igrejas. (Ferreira A., 2011) [121].
Apesar da atracção paisagística, o Parque Natural da Arrábida e Reserva Natural do Estuário do Sado que estes dois territórios oferecem pelo facto de estarem enquadrados num parque natural e numa reserva respectivamente, o seu uso para o desenvolvimento de actividades económicas é muito limitado. Enquanto patrimónios protegidos, são objecto de uma regulamentação específica muito restritiva, a fim de preservar os valores naturais, o que condiciona muito a sua utilização, constituindo este factor um impedimento concreto à “comercialização” enquanto produtos turísticos [121].
A Baía de Setúbal pertence, actualmente, ao restrito clube das mais belas baías do mundo. A concessão deste estatuto reflecte uma série de parâmetros únicos, que lhe atribui um carácter de excelência. Os critérios justificativos da atribuição passaram pela envolvente geográfica, paisagística, fauna e flora da Baía; destaca-se o roaz-corvineiro, símbolo da Costa Azul. A área da baía encontra-se dentro do limite da Reserva Ecológica Nacional (REN), que interdita as operações de loteamento, escavações, destruição do coberto vegetal em estuários, lagunas, zonas costeiras, zonas húmidas adjacentes e faixas de protecção. Para além disso, existem áreas inseridas em Zona de Protecção Especial (ZPE) para a Avifauna da Reserva do Estuário do Sado e da Rede NATURA 2000. A Baía de Setúbal tem sido objecto de diversos estudos que visam o ordenamento dos diferentes usos e actividades específicos da orla costeira, a classificação das praias e a regulamentação do uso balnear, a valorização das praias consideradas estratégicas por motivos ambientais e turísticos, a orientação do desenvolvimento de actividades específicas da orla costeira e a defesa e conservação da natureza. Mas, também aqui, a autarquia pouco pode fazer no sentido de dinamizar a sua utilização em termos económicos, pois está integrada na Reserva do Estuário do Sado [121].
Ao longo da orla costeira de Setúbal, podem encontrar-se diversas construções e edificações que representam uma importante parte do património histórico e cultural do concelho. As mais representativas são: Aqueduto de Setúbal, Casa das Quatro Cabeças, Casa do Bocage, Casa da Luísa Todi, Forte de São Filipe, Cruzeiro de Setúbal, Forte de Santiago do Outão, Convento de Jesus, Lapa de Santa Margarida e Estrada Romana [122].
Algumas empresas neste momento já estão a aproveitar economicamente estes recursos, tornando-os produtos turísticos, nomeadamente os passeios pela serra e estuário e a observação dos golfinhos. Contudo, ainda não têm uma verdadeira expressão quer no mercado nacional quer internacional. Muito mais poderá vir a ser feito de forma a rentabilizar todas as potencialidades oferecidas por este conjunto de recursos naturais (formação e novas empresas locais). Mas temos de ter sempre presente que apesar de as belezas naturais deste nosso território, aliadas a toda a outra riqueza patrimonial, poderem sem sombra de dúvida constituir um forte atractivo (servindo deste modo de base ao desenvolvimento da economia do turismo), as condicionantes atrás apresentadas, nomeadamente as regulamentações específicas existentes para as áreas protegidas, colocam grandes entraves ao desenvolvimento desta indústria do turismo no concelho [122].
As infra-estruturas de apoio às empresas de Setúbal foram apontados como pontos fortes e potencialidades a serem exploradas. Devido à proximidade a Lisboa (e das suas excelentes vias de comunicação), temos acesso às principais auto-estradas do país, caminho-de-ferro e um porto marítimo que conferem ao concelho um estatuto único no contexto nacional. Se juntarmos a isto a existência de parques industriais infra-estruturados, centros de apoio à criação e acolhimento de novas iniciativas empresariais, e uma mão-de-obra bastante qualificada, estamos perante um concelho com recursos únicos que, devidamente optimizados e conjugados com outras potencialidades, podem colocar-nos num patamar de desenvolvimento sustentado muito superior ao actual. Assim, conjugando o seu posicionamento estratégico com as infra-estruturas existentes direccionadas para as empresas, o concelho oferece condições únicas para quem pretende investir. As empresas de pequena dimensão representam cerca de 98% das instaladas no concelho. São estas que têm maiores dificuldades em encontrar organismos de apoio e as informações necessárias para a sua instalação, por um lado, devido à falta de formação e de conhecimento por parte dos empresários e, por outro, dada a dispersão e desarticulação que às vezes se verifica entre os vários serviços que tutelam esta matéria, sendo necessário procurar promover um maior entendimento e cooperação entre os vários organismos existentes: Instituto de Emprego e Formação Profissional; Gabinete de Apoio ao Empresário; Centro de Apoio aos Desempregados; balcão “Passo a Passo”, IAPMEI; CFE, destinados a prestar apoio aos empresários [122].
121 Ferreira, A. (2011) “A Sustentabilidade Territorial de um Cluster do Mar em Portugal”, Tese de Doutoramento em Geografia e Planeamento Territorial, Especialidade Território e Desenvolvimento , Lisboa.
122 Diagnóstico Social da Rede Social de Setúbal, “Capitulo Actividades Económicas e Emprego” [Online]. Available: http://redesocial.mun-setubal.pt/page6/downloads-3/files/ActEconomicaseEmprego.pdf. [Acedido em Dezembro 2018].
Setúbal é um importante centro piscatório, tendo também uma actividade agrícola de alguma importância e diversidade de ocupações que atraiu gente de várias zonas. Grande parte da gastronomia local assenta em pratos de peixe. Mas a migração de população das regiões do Alentejo e Algarve trouxe alterações à gastronomia, com a introdução de novos pratos de carnes e aves, e de açordas que se adaptaram a mariscos e peixes [96].
Quanto às ostras, um dos pratos típicos de Setúbal é a espetada de ostras e presunto. Outro prato típico, de Azeitão, é o Faisão à D. Brites, algo a servir em grandes ocasiões, visto que o faisão é uma ave de grande requinte. O faisão era depenado e limpo, depois de previamente lhe serem retiradas a cabeça e as asas com penas, que se reservam. Os miúdos eram guardados no fresco e o faisão era pendurado ao ar durante dois dias. Passado esse tempo, o faisão era temperado com manteiga, toucinho, sal e pimenta e cozinhado ao lume. Era servido trinchado e enfeitado com a cabeça e as asas com penas [123].
Fazem ainda parte da gastronomia da cidade, as bebidas espirituosas (vinho moscatel, licores), queijos, frutos e doçaria típica e variada. A torta de laranja (Figura 23), o doce de laranja, que é apresentado em pequenos barcos (Figura 23B), as tortas de Azeitão (Figura 23), os “amores” (Figura 23) e os “esses” de Azeitão (Figura 23) são alguns exemplos. Como se pode verificar, a região tem doces com base na laranja devido à sua grande produção na zona [96].
Uma das novidades na doçaria da região são as ostras doces (Figura 24), uma iguaria com a forma da ostra (uma casca tipo queijada) e recheada com doce de laranja [124].
O peixe é, no entanto, a iguaria mais importante na cozinha local. A sardinha, o carapau e as cavalas eram os principais peixes pescados e eram os mais destacados na sua alimentação e na indústria de conservas – o salmonete e a caldeirada à setubalense eram, no entanto, os pratos mais emblemáticos e que caracterizavam já uma cozinha mais rica e também tradicional. (ver nota 96)
É também muito comum encontrar nesta zona restaurantes da região que servem sardinhas assadas, normalmente servidas com batata cozida e salada de alface, temperada com azeite e vinagre. Muitos dos restaurantes têm como especialidade da casa choco frito, um choco envolvido em pão ralado e ovo, e depois frito. É um dos pratos mais procurados pelos visitantes da cidade sadina. No mercado do Livramento, o principal mercado da cidade, o produto mais comercializado continua a ser o peixe, um hábito já enraizado na população da cidade. Nas ruas estreitas, vêem-se os fogareiros a grelhar peixe para os clientes dos restaurantes, sendo também comum os residentes grelharem peixe à porta das suas casas. A sardinha e o carapau assados são um elemento diferenciador da alimentação na região de Setúbal. É tomado como um acto de socialização comer sardinhas assadas na brasa, em conjunto, à volta do assador, com uma fatia de pão, salada com pimentos e vinho. Ainda hoje, no bairro de Troino, é comum os pescadores, quando regressam da faina e o peixe é abundante, distribuírem o peixe pelos vizinhos [96].
O interesse no consumo de pescado, nomeadamente ostras, continua presente na população de Setúbal. Ao longo deste trabalho, podemos verificar que é de grande importância as relações desta região com o mar e com o rio, deduzindo-se mesmo que a existência da cidade passa pela vida essencialmente marinha, por necessidade geográfica.
A sobrevivência da cidade, tal como o seu desenvolvimento, depende, pois, do rio e do mar, que dão a Setúbal um cunho muito especial. O rio Sado serpenteia os arrozais de Alcácer do Sal, onde navegavam os velhos galeões do sal, hoje transformados em barcos de passeio para turistas visitarem a cidade.
Um quotidiano e uma história desenvolvidos em função do mar e dos produtos que daí se retiram, vendem e transformam, explicam como ao longo do tempo os setubalenses sempre tiveram o mar à mesa.
No bairro de Troino, ainda há pescadores que são proprietários de restaurantes, e parte do peixe da faina é servido à mesa. A autenticidade e a frescura valorizam o conceito do restaurante que escoa o pescado da própria actividade.
Consumo comunitário, uma economia de proximidade caracterizada pelo sistema de trocas directas entre pequenos produtores de hortas e pescadores, que, quando o peixe é abundante, é distribuído pelos vizinhos.
Neste seguimento, também seria interessante investigar a forma como o consumo sustentável é percebido pelos consumidores, devido ao elevado consumo de ostras nesta região. As ostras são um produto sensível, vulnerável e frágil, não sendo isso impeditivo de chegar aos consumidores de forma inovadora, nomeadamente o caso de “Ostras Sobre Rodas”, um projecto recente de street-food criado à beira-mar.
A aquicultura em Setúbal, especialmente a de produção de ostras, está a tornar a região mais atractiva, traduzindo-se no aumento de visitas turísticas guiadas às zonas de sapal, onde a produção de ostras está enquadrada na Reserva Natural do Estuário do Sado. Esta, em 2010, criou o programa “A Ostra-Portuguesa – Recuperação de Um Património”, para sensibilizar, mobilizar e divulgar o consumo e a defesa da ostra-portuguesa. Por existir uma enorme diversidade de habitats naturais de muitas espécies e que funciona como abrigo, torna-se crucial qua a actividade turística seja controlada, para não pôr em perigo a sua preservação.
É fundamental existir uma maior preocupação quanto à sustentabilidade das espécies capturadas e, por esse motivo, seria importante promover uma classificação territorial de produção protegida (DOP) para as ostras, à semelhança de outros produtos regionais.
Assistimos já a uma massificação turística, não só na área urbana, mas também no estuário, com o “Turismo de Natureza”, que contempla visitas aos bancos de ostras, onde existe uma enorme diversidade de habitats naturais de muitas espécies que é preciso cuidar e preservar. Daí ser fundamental sensibilizar a população, mantê-la informada e torná-la mais consciente das suas escolhas, nomeadamente através de uma maior divulgação do pescado de aquicultura como alternativa segura para consumo.
Para complementar os estudos, seria vantajoso analisar as variáveis ambientais e comportamentais que possam afectar o desenvolvimento de novos hábitos alimentares, inclusive factores como o consumo de pescado na infância e na adolescência ou a familiaridade com as espécies de pescado.